OBJETIVO GENERAL
· Adquirir los conocimientos teórico-prácticos para la obtención de compuestos proteicos con actividad hemoaglutinante a partir de extractos vegetales.
OBJETIVOS ESPECÍFICOS
· Determinar la actividad hemoaglutinante de los extractos obtenidos.
· Investigar el método de conservación no destructivo de las lectinas obtenidas (liofilización).
· Confirmar las características reportadas en las referencias para los compuestos obtenidos, tales como pesos moleculares.
· Realizar la electroforesis en SDS-PAGE de las lectinas extraídas.
· Familiarizarse con la técnica de SDS-PAGE y sus potenciales aplicaciones.
INTRODUCCIÓN
Las lectinas vegetales son un grupo variado de proteínas, ampliamente distribuidas en la naturaleza, encontrándose en plantas, animales y organismos inferiores. Las lectinas, especialmente las vegetales, se han utilizado ampliamente en la purificación de receptores celulares glicosilados. Las lectinas son capaces de reconocer carbohidratos con una alta especificidad, lo que ha permitido su utilización como modelos para estudiar la interacción carbohidratoproteína (Hernández, 2005).
Las lectinas aisladas de leguminosas es la familia de lectinas vegetales más estudiada, generalmente se encuentran constituidas por dos o cuatro subunidades idénticas de 25 a 30 kDa, cada una de las subunidades contiene un sitio de unión para iones metálicos Ca+2, Mn+2 y Mg+2.
La liofilización es un método de desecación en el que se elimina agua por congelación del producto húmedo y posterior sublimación del hielo en condiciones de vacío (Blakebrough, 1979). Las ventajas que ofrece la liofilización son obtener productos de redisolución rápida, la forma y características del producto original son esencialmente las originales, contenido muy bajo de humedad final y es un proceso idóneo para sustancias termolábiles (Walsh, 2007).
La electroforesis es la migración de iones en un campo eléctrico. Es una de las técnicas analíticas más importantes dentro de la Bioquímica. Las moléculas biológicas (ADN, proteínas o vitaminas) poseen cargas eléctricas, y por tanto poseen esta propiedad de movilidad en un campo eléctricos. La movilidad dependerá de la carga que presentan al pH que se trabaje. La electroforesis en gel es el método más conveniente para realizar separaciones de macromoléculas (ADN y proteínas). El soporte de la electroforesis (el gel) es un entramado tridimensional que impide o reduce la difusión. Este gel ha de ser compatible con los buffers usados y debe permitir la entrada del líquido en los poros (reticulados hidratables).
FUNCIÓN DE LOS REACTIVOS
Solución salina PBS/NaCl : Aumenta la permeabilidad de las membranas por efecto de la difusión.
Acrilamida / bisacrilamida: Forman una poliacrilamida, que es un soporte empleado frecuentemente en electroforesis en gel. Es químicamente inerte, de propiedades uniformes, capaz de ser preparado de forma rápida y reproducible. Forma, además, geles transparentes con estabilidad mecánica, insolubles en agua, relativamente no iónicos y que permiten buena visualización de las bandas durante tiempo prolongado. Además tiene la ventaja de que variando la concentración de polímeros, se puede modificar de manera controlada el tamaño del poro (Campell MK. Biochemistry. Second edition. Saunders College Publishing.1995).
Los geles de poliacrilamida se forman por la polimerización vinílica del monómero acrilamida CH2=CH-CO-NH2 y del monómero entrecruzador N, N'-metilen-bis-acrilamida CH2 = CH- CO - NH - CH2 - NH - CO - CH = CH2. La polimerización se inicia con la formación de radicales libres del monómero, que se producen por radicales libres de oxígeno, por causa de la acción de iones persulfato (Chávez Planes MA,Díaz Brito J, Pérez U, Delfín J. Temas de enzimología. Tomo 2. Facultad de Biología Universidad de La Habana, 1990).
TEMED: El N, N, N, N´-tetrametilen-diamina (TEMED) es una amina terciaria que se emplea como catalizador de la reacción Acrilamida/Bisacrilamida porque causa la formación de radicales libres del persulfato ( Garfin DE. One dimensional gel electrophoresis. Methods in enzymology. vol 182. Academic press.1990).
Persulfato de amonio: Se utiliza como agente oxidante junto al TEMED como agente reductor en la reacción de polimerización del gel. Una polimerización muy rápida puede deformar las bandas, porque ocurre una contracción no uniforme del gel, en este caso debe reducirse el TEMED y el persulfato de amonio o adicionar ferricianuro de potasio, con el objetivo de hacerla más lenta. El empleo de niveles bajos de catalizador provoca que la superficie del gel se torne desigual y tienda a romperse con facilidad, pero el empleo de altas concentraciones provoca que los geles tiendan a cuartearse. Este problema puede solucionarse en geles de altas concentraciones.
2-mercaptoetanol (β-mercaptoetanol, β-met, HOCH2CH2SH): Es un híbrido entre el etilenglicol, y el 1,2-etanoditiol que se emplea para reducir los puentes disulfuro y puede actuar como antioxidante biológico, reciclando radicales hidroxilo. Es un agente reductor que se utiliza para romper los enlaces disulfuro y asegurarse de que la proteína está completamente desnaturalizada antes de ser cargada en el gel y garantizar que corre de manera uniforme.
Dodecilsulfato sódico (SDS; C12H25NaO4S; Mr = 288,38): Es el agente disociador más habitual para desnaturalizar proteínas nativas en sus polipéptidos individuales. Cuando se calienta brevemente una mezcla de proteínas a 100 °C en presencia de SDS, el detergente que cubre el polipéptido alrededor de su eje central se mantiene desplegado. En este proceso, las cargas intrínsecas del polipéptido son despreciables en comparación por las aportadas por el SDS. De este modo los polipéptidos se transforman después del tratamiento en estructuras con forma de bastón que poseen una densidad de carga uniforme en toda su longitud. La movilidad de estas proteínas es una función aproximadamente lineal del logaritmo de su masa molecular.
Azul de bromofenol (3',3",5',5"-tetrabromofenolsulfoftaleína; C19H10Br4O5S; Mr = 669,99): Es el colorante trazador más empleado porque es viable en pH neutro y alcalino. Al ser una molécula pequeña se “adelanta” a la mayor parte de proteínas y ácidos nucleicos., es ionizable y posee carga negativa a pH superior a 4,6
Glicerol (C3H8O3; Mr = 92,09): Contribuye a que la muestra quede depositada en el pozo por su alto peso molecular además de conferirle carga negativa
Azul de Coomassie (C45H44N3NaO7S2; Mr = 825,97): Es un colorante aniónico para proteínas. Su estructura es no polar por lo que se utiliza en solución con ácido acético y metanol. Las proteínas del gel se fijan gracias al ácido acético y al mismo tiempo se tiñen. El colorante en exceso que se incorpora en el gel se puede eliminar destiñendo con una disolución de composición idéntica excepto por el colorante. Las proteínas se detectan como bandas azules contra un fondo claro. Al teñir, el SDS puede interferir el proceso ya que también es aniónico por lo cual generalmente se utiliza un gran volumen de disolución de tinción (aproximadamente 10 veces el volumen del gel).
RESULTADOS
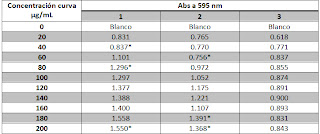
Tabla 1.- Resultados de las absorbancias obtenidas dependientes de la concentración de albumina presentes en la muestra.
*Representa que esos datos fueron descartados al realizar la regresión lineal
Tabla 2.- Resultados de las absorbancias obtenidas, dependientes de la concentración de proteínas presentes en cada una de las muestras de los diferentes tipos de frijol.
Figura 1.- Grafico de la relación de las concentraciones de albumina y las absorbancias obtenidas (Tabla 1, con datos de la columna 2), obteniendo una ecuación de la recta de
y = 0.0042x + 0.640 y un R² = 0.9402
Tabla 3.- Resultados de las concentraciones de proteínas presentes en el agua de remojo, endospermo y cascarilla.
* Ver memoria de cálculos
Figura 2.- Marcador de peso molecular (albumina bovina, PM = 67 kDa) de lado derecho (corrimiento bibliográfico de la albumina en un gel de policriamida 10 %), de derecha a izquierda se localiza el marcador de peso molecular (albumina bovina), muestras de agua de remojo, cascarilla y endospermo respectivamente. Se muestran lineas sobre la imagen para derterminar el lugar donde se encuetra acumulación de proteínas.
Tabla 4.- Resultados del peso molecular aproximado obtenido por electroforesis SDS-PAGE.
Figura 3.- Resultados de la hemoaglutinación; donde podemos ver que la aglutinación fue mayor en la muestra de endospermo, posteriormente en la cascarilla y en agua de remojo la aglutinación no es significativa en comparación de las muestras anteriores.
DISCUSIÓN DE RESULTADOS
Las lectinas se encuentran ampliamente distribuidas en la naturaleza y han sido identificadas en diversos organismos como virus, bacterias, hongos, plantas, así como en vertebrados superiores. Aunque varias de estas proteínas poseen especificidad por estructuras sacarídicas semejantes, presentan actividades biológicas diversas, como son: la aglutinación de eritrocitos de diferentes especies, la estimulación mitogénica de linfocitos e inhibición de la fagocitosis. Debido a la capacidad de estas proteínas para interactuar con células de la respuesta inmune, algunas lectinas poseen efectos inmunosupresores, otras también son tóxicas, inhiben el crecimiento de células tumorales y participan en la adhesión celular. Todas las actividades biológicas reportadas para las lectinas tienen en común el reconocimiento de un receptor oligosacarídico (Mikami, 1994).
Las lectinas vegetales pueden tener diversas funciones: participan en las interacciones entre las bacterias fijadoras de nitrógeno con la raíz de plantas de leguminosas, poseen actividad mitogénica, pueden tener efectos protectores en contra de la acción patogénica de ciertos microorganismos como es el caso de los nemátodos herbívoros. En diversas especies animales se han reportado evidencias de que las lectinas participan en fenómenos tales como el reconocimiento y la eliminación de glicoproteínas del sistema circulatorio, así como de células envejecidas, células tumorales y microorganismos, mediante un proceso de opsonización y la participación de células con actividad fagocítica. Las lectinas también participan en procesos de reconocimiento que permiten la diferenciación celular, la organogénesis, la migración de linfocitos y como factores determinantes en la metástasis (Sharon, 1984).
En la industria farmacéutica, la liofilización se aplica en productos de origen humano, como plasma, hemoderivados, leche, huesos, córneas; origen animal, como sueros, antígenos, enzimas; de origen vegetal, extractos, antibióticos, vitaminas, y de microorganismos, vacunas, bacilos lácticos, cultivos tipo. Según Sobral y Wagner (2009) las lectinas si pueden ser sometidas a liofilización por ser productos termolábiles.
Prueba de hemoaglutinación
La hemoaglutinación es la aglutinación de los hematíes o glóbulos rojos, por una reacción que se produce con una proteínas (generalmente anticuerpos) específicas que detectan una proteína o un oligosacarido (para el caso de las lecitinas) de superficie de los glóbulos rojos y hace que precipiten(Hernández,et al,1999). Las lectinas de la familia de las leguminosas, independientemente de su especificidad reconocen a los carbohidratos gracias a la presencia de tres aminoácidos invariantes: ácido aspártico, asparagina y un residuo aromático o una leucina. El hecho de que los aminoácidos del sitio de reconocimiento se encuentren altamente conservados en todos los miembros de una familia, sugiere que la especificidad esta dada por la orientación de los monosacáridos en el sitio de reconocimiento(Hernández, et al,2005 ). (Ver figura 4)
Figura 4. El sitio de reconocimiento a carbohidratos de lectinas extraídas de leguminosas, α-metil manósido en Con A.
Como se puede observar en la figura 3 la aglutinación de la sangre con la muestras de endospermo, cascarilla y agua de remojo, no sucede en la misma proporción; este resultado se debe a la cantidad de lectinas presentes en cada muestra. Por lo que se estima que la presencia de lecitinas es mayor en el endospermo, después en cascarilla y finalmente en el agua de remojo:
Endospermo >> Cascarilla >> Agua de remojo
Es importante conocer este tipo de propiedades pues en base a ellas se pueden dar un amplio uso de las mismas, como en la elaboración de reactivos de diagnóstico, agentes terapéuticos o reactivos para procesos de purificación. Las lectinas aisladas de diversas fuentes vegetales han demostrado ser herramientas útiles en la investigación biomédica, en donde se les utiliza para
la tipificación de grupos sanguíneos y bacterianos. Recientemente, se ha propuesto su utilización como auxiliares en el transplante de médula ósea de pacientes con inmunodeficiencias severas. La actividad mitogénica de algunas lectinas ha sido muy importante para el análisis de los eventos bioquímicos que se desarrollan durante la estimulación de los linfocitos in vivo y son aplicadas en la valoración de la actividad celular de diferentes enfermedades infecciosas. Las lectinas también han sido empleadas en la separación de poblaciones celulares. De igual forma, estas proteínas inmovilizadas en un soporte inerte son utilizadas para purificar macromoléculas que contienen
carbohidratos, por ejemplo glicoproteínas, enzimas, hormonas y diversos receptores de membrana, entre los que destacan el receptor para la insulina (Hernández, et al,2005 )
Cuantificación de proteínas
El método de Bradford de cuantificación de proteínas está basado en el cambio de color del colorante Coomassie brilliant blue G-250 en respuesta a diferentes concentraciones de proteínas. Este compuesto interacciona con aminoácidos básicos (especialmente arginina) y aromáticos. Esta unión del colorante con las proteínas provoca un cambio en el máximo de absorción del colorante desde
Estructura química del azul de Comassie.
Algunas ventajas y/o desventajas del método de Bradford son:
- La intensidad de absorción depende del contenido de aminoácidos básicos y aromáticos.
- El complejo colorante-proteína tiene un alto coeficiente de extinción lo cual es imprescindible para aumentar la sensibilidad en la medición de proteínas.
- La unión colorante-proteína es un proceso muy rápido (2min) y el complejo permanece estable durante un tiempo relativamente largo, una hora. Haciendo de este un proceso muy rápido, y que no requiere un tiempo crítico para el ensayo.
- Se pueden utilizar un gran número de muestras (muy reproducible) y es adaptable a la automatización.
- Las interferencias o no existen o son mínimas por cationes tanto sodio como potasio y carbohidratos como la sacarosa. Otras sustancias que interfieren en el ensayo son los agentes fuertemente alcalinos (fácilmente solucionable con la utilización de buffers).
Se realizó una curva tipo tomando como referencia concentraciones de albumina, a partir de esto se obtuvo una relación para los de absorbancia y concentración de albumina (ver figura 1); con la que se calculo la concentración de lectinas que había en las muestras (ver memoria de cálculos) y se obtuvo que hay una mayor concentración en la muestra de endospermo, posteriormente en agua de remojo y finalmente en la cascarilla:
Endospermo >> Agua de remojo >> Cascarilla
13 180.950 μg/mL > 2 623.810 μg/mL > 1 904.76 μg/mL (Datos tomados de la tabla 3)
Los datos anteriores verifican el resultado de la hemoaglutinación para la muestra de endospermo, sin embargo, son contradictorias para el caso de la cascarilla y el agua de remojo, pues según las concentraciones obtenidas (mayor en agua de remojo que en la cascarilla) se debió distinguir una mayor aglutinación para la muestra de agua de remojo (ver figura 2) que no se verificó en la experimentación. Esto se puede deber a que la hemaglutinación no es tan exacta como hacer una medición espectrofotométrica, la cual nos da información mas exacata acerac de las concentraciones de lectinas.
En este caso no es comparable con los otros equipos puesto que cada equipo utilizop un tipo de frijol diferente, y pues las características no son las miasmas, en unos equipos las cascarilla presentaba mayor concentración de proteínas y en otros el agua de remojo presentaba mayor cantidad, entonces es subjetivo comparar.
Los frijoles poseen un alto contenido en proteínas y en fibra, siendo así mismo una fuente excelente de minerales, su contenido nutricional promedio por cada 100 gramos de alimento crudo en peso neto es el siguiente:
Valor nutricional por cada 100 g
Energía 330 kcal 1390 kJ
Electroforesis SDS-PAGE
Para llevar a cabo la electroforesis se necesita:
a) una fuente de voltaje que proporciona el campo eléctrico, mediante dos electrodos, positivo (ánodo) y negativo (cátodo), entre los que se establece la diferencia de potencial.
b) un recipiente, en cuyos extremos se sitúan los electrodos.
c) un soporte electroforético.
d) el buffer de electroforesis: durante la electroforesis se produce electrolisis del agua, generándose protones en la proximidad del ánodo e iones hidroxilos en la proximidad del cátodo; el tampón evitará que el entorno anódico se acidifique y el catódico se haga más básico a lo largo de la electroforesis y el pH varíe.
En la experimentación se hizo electroforesis en condiciones desnaturalizantes con la presencia de algunos compuestos químicos con los que las proteínas perdieron su estructura nativa; entre ellos se encuentra el SDS un detergente aniónico que despliega a las proteínas y se queda pegado a su superficie confiriéndole una gran carga negativa; también se uso el mercaptoetanol que se encarga de eliminar los puentes disulfuro que forman la estructura terciaria de las proteínas. Por otra parte, los puentes de hidrógeno también están implicados en el mantenimiento de la estructura de las proteínas. Estos puentes de hidrógenos se pueden romper fácilmente por tratamiento con calor. Estos agentes desnaturalizantes producen el desplegamiento de las proteínas que quedan si su organización tridimensional característica de su funcionalidad biológica.
Figura 5.(1) reacción de polimerización entre los monómeros acrilamida y mertilenbisacrilamida en presencia de persultato como agente iniciador de la polimerización como también lo hace el TEMED (2) Estructura del SDS, detergente aniónico (3) Relación de la movilidad de las proteína en base a su masa.
Como ya se ha comentado, la movilidad electroforética en una PAGE es función del tamaño y de la carga por unidad de masa; como ésta es constante para todos los complejos SDS-proteína, esta movilidad es solamente función de la masa molecular, es decir, cuanto menor sea la masa molecular de la proteína, mayor será la movilidad de la misma y viceversa.
La SDS-PAGE es la electroforesis más utilizada para el análisis de proteínas debido a:
La gran mayoría de las proteínas son solubles en SDS.
Todos los complejos SDS-proteína tienen carga negativa y migran, por lo tanto, en el mismo sentido.
Su densidad de carga es muy elevada, por lo que su velocidad de migración también lo es y las electroforesis son muy rápidas.
La separación depende de un parámetro físico-químico, como es la masa molecular, que se puede calcular.
Los complejos SDS-proteína se tiñen fácilmente
Las lectinas aisladas de leguminosas se encuentran, generalmente, constituidas por dos o cuatro subunidades idénticas de 25 a 30 kDa(Hernández, et al,2005 ) En base a la tabla 4 donde se estimo el peso molecular en base al corrimiento de albumina bovina , obteniendo que los pesos para las proteínas de 60 kDa para el agua de remojo, 43 kDa para las proteínas presentes en la cascarilla y 28 kDa para las que se encuentran en el endospermo. Por lo que se puede suponer que en el agua de remojo existe una lectina con dos subunidades de 30 kDa cada una y que en las demás muestras las lectinas no se encuentran en su forma nativa, por lo que se registran pesos moleculares de 43 y 28 kDa en cascarilla y agua de remojo respectivamente, que pueden correspondes a subunidades independientes de las lectinas. Por otro lado en base al grado de tinción del gel se visualiza una gran cantidad de proteínas en la muestra con endospermo y muy similares entre las muestras de cascarillas y agua de remojo:
Endospermo >> Cascarilla ≥ Agua de remojo
CONCLUSIONES
Se lograron obtener compuestos proteicos (lectinas) a partir de frijoles, esto se comprobó mediante la uan técnica conocida como hemaglutinación
Se observo que las proteínas obtenidas de los frijoles tuvieron una actividad hemaglutinanate, esto es debido a que el antígeno de los globulos rojos hizo reacción con las proteínas, puesto que los anticuerpos son proteínas.
Mediante una electroforesis SDS-PAGE se logro determinar el PM de las proteinas encontradas en el endospermo, en la cascarilla y en el agua de remojo, utilizando un marcador de peso molecular que fue la albumina; esta técnica es especialmente para proteínas.
Mediante el método de Bradford se pudo conocer las concentraciones de proteínas presentes el el endospermo, la cascarilla y el agua de remojo; utilizando una curva tipo de la albumina a diferentes concentraciones.
En la industria farmacéutica, la liofilización se aplica en productos de origen humano, como plasma, hemoderivados, leche, huesos, córneas; origen animal, como sueros, antígenos, enzimas; de origen vegetal, extractos, antibióticos, vitaminas, y de microorganismos, vacunas, bacilos lácticos, cultivos tipo.
-Alberts, B., Bray, B., Lewis, J., Raff, M., Roberts, K., y Watson, J. (2002). Biología molecular de la célula (3a ed.). Barcelona, España: Ediciones Omega. ISBN: 84-282-1011-X
-Blakebrough, N., Fiechter, A. and Ghose, T. K. (1979). Advances in Biochemical Engineering. Vol. II (1a Ed.). Berlin, Germany: Edit. Springer-Verlag. ISBN: 0-387-08990-X
-Bradford, M. (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-254 (1976).
-Crommelin y Sindelar (2002). Pharmaceutical biotechnology. 2da edición. Editorial Taylor & Francis Group.USA. p.p 44-46
-Groves, M. (2006). Pharmaceutical biotechnology (2ª ed.). E. U. A.: Taylor & Francis. ISBN-10: 0-8493-1873
-Hernández, P., Pérez, E. Martínez, L., Ortiz, B. y Martínez, G. (2005). Las lectinas vegetales como modelo de estudio de las interacciones proteína-carbohidrato. Departamento de Bioquímica, UNAM. REB 24 (1): 21-27, 2005
-Hernández, et al. (1999). Aplicaciones de las lectinas. Revista cubana: Hemato Inmunol Hemuter. Núm. 15. Vol. 2 . pp. 91-95
-Kayser, O. and Müller, R. H. (2004). Pharmaceutical Biotechnology, Drug Discovery and Clinical Applications (1a Ed.). Weinheim, Germany: Edit. Wiley-VCH. ISBN: 3-527-30554-8
-Klefenz, H. (2002). Industrial pharmaceutical biotechnology (1a Ed.). Bornheim, Germany: Edit. Wiley-VCH. ISBNs: 3-527-60012-4
-Lisdat, F. and Renneberg, R. (2008). Advances in Biochemical Engineering/Biotechnology. Berlin, Germany: Edit. Springer-Verlag. ISBN: 978-3-540-75201-1
-Mikami B, Degano M, Hebre E J y Sacchetini J C (1994) A crystal structure of soybean beta-amylase reacted with beta-maltose and maltal: Active site components and their apparent roles in catalysis. Biochemistry 33: 7779-7787.
-Novo, F. J. (2007). Genética Humana. Conceptos, mecanismos y aplicaciones de la Genética en el campo de la Biomedicina (1ª ed.). Madrid, España: Person Prentice-Hall. ISBN: 978-84-8322-359-8
-Sobral y Wagner.(2009).Relación entrela composición y la actividad antitríptica de sueros de soja y tofu, y comportamiento térmico de sus proteínas aisladas. Revista : infromación tecnológica . Vol. 20. Núm 5. pp. 65-73
-Sharon N (1984) Surface carbohydrates and surface lectins are recognition determinants in phagocytosis. Immunol Today 5: 1-5.
-Walsh, G. (2007). Pharmaceutical Biotechnology. Concepts and Applications (1a Ed.). England: John Wiley & Sons. ISBN: 978-0-470-01244-4
Mike Adams.Organic chemistry is the chemistry of carbon compounds. Biochemistry is the study of carbon compounds that crawl.
(La química orgánica es la química de los compuestos de carbono. La bioquímica es el estudio de los compuestos de carbono que andan a cuatro patas).
(La química orgánica es la química de los compuestos de carbono. La bioquímica es el estudio de los compuestos de carbono que andan a cuatro patas).