Nota: Este protocolo de validación es sólo un ejemplo, ninguno de los nombres mencionados se refieren a personas reales. Los parámetros usados para comprimidos de diazepam son a forma de guía, no necesariamente los más precisos.
====================================================================
TRANSCRIPT:
PROTOCOLO DE VALIDACIÓN DE COMPRIMIDOS DE DIAZEPAM DE 5 mg
VPVP/R-002.01
Contenido
1. Objetivo
Validar el proceso
de fabricación de tabletas de diazepam 5 mg, para asegurar que su proceso de
fabricación es capaz de cumplir de forma consistente y repetitiva las especificaciones
establecidas.
2. Alcance
Éste protocolo se aplica a los lotes A, B y C
de comprimidos de diazepam de 5 mg, con un tamaño de lote de 100,000 unidades.
3. Responsabilidades
Es responsabilidad del Departamento de Validación elaborar el Protocolo de Validación. Ejecutar la validación y llenar
en campo las Hojas de Trabajo correspondientes a cada prueba. Realizar las
mediciones de las variables físicas que se requieran. Verificar y firmar las
Hojas de Trabajo durante la ejecución de la validación, así como de recopilar
los datos obtenidos durante la validación y su interpretación. Elaborar el
Informe de Validación.
Es responsabilidad del Gerente de
Aseguramiento de Calidad (Responsable Sanitario) autorizar el Protocolo de
Validación. Aprobar las Hojas de Trabajo. Verificar la aplicación, cumplimiento y avalar los resultados y
dictámenes emitidos durante la ejecución del presente Protocolo.
Es responsabilidad del personal químico de
Control de Proceso llevar a cabo los análisis necesarios para dictaminar y
liberar la limpieza de las áreas y equipos involucrados.
Es responsabilidad del personal que intervenga
en la aplicación de este Protocolo cumplir con los lineamientos de seguridad e
higiene establecidos en las Buenas Prácticas de Fabricación.
4. Definiciones
Calidad, al
cumplimiento de especificaciones establecidas para garantizar la aptitud de
uso.
Calificación, a la realización de las pruebas específicas basadas en conocimiento
científico, para demostrar que los equipos, sistemas críticos,
instalaciones, personal y proveedores cumplen con los requerimientos
previamente establecidos, la cual debe ser concluida antes de validar los
procesos.
Calificación de desempeño, a la evidencia documentada de que las instalaciones, sistemas,
y equipos se desempeñan cumpliendo los criterios de aceptación previamente
establecidos.
Calificación de diseño, a la evidencia documentada que demuestra que el diseño propuesto de
las instalaciones, sistemas y equipos es conveniente para el propósito
proyectado.
Calificación de instalación, a la evidencia documentada de que las instalaciones, sistemas
y equipos se han instalado de acuerdo a las especificaciones de diseño
previamente establecidas.
Calificación de operación, a la evidencia documentada que demuestra que el equipo, las instalaciones
y los sistemas operan consistentemente, de acuerdo a las especificaciones de
diseño establecidas.
Desviación o no
conformidad, al no cumplimiento
de un requisito previamente establecido.
Documentos maestros, a los documentos autorizados que contienen la información para
realizar y controlar las operaciones de los procesos y actividades
relacionadas con la fabricación de un producto.
Eficacia, al grado en que una intervención o tratamiento origina un resultado
esperado en ciertas condiciones, medido en el contexto de un Ensayo
Clínico o Preclínico Controlado.
Fecha de re análisis, a la fecha límite para utilizar un fármaco o aditivo;
para continuar usándolo deberá
ser nuevamente muestreado y analizado con la finalidad de confirmar que
continúa cumpliendo las especificaciones
de calidad establecidas.
Orden de producción, a la copia de la orden o fórmula maestra de producción a la cual se le
asigna un número de lote y se utiliza para el surtido y registro de los
insumos para la producción de un lote de medicamento.
Partículas viables, a cualquier partícula que bajo condiciones ambientales apropiadas
puede reproducirse.
Peor caso, a la condición o conjunto de condiciones que abarcan límites y
circunstancias superiores y/o inferiores de procesamiento, dentro de
procedimientos de operación normalizados, que poseen la mayor oportunidad
de falla en el proceso cuando se compara con condiciones ideales. Tales
condiciones no inducen necesariamente a fallas en el producto o proceso.
Periodo de re análisis, al tiempo durante el cual un fármaco o aditivo que es conservado en
las condiciones indicadas por el fabricante, permanece dentro de las
especificaciones de calidad establecidas para su uso.
Plan maestro de
validación, al
documento que especifica la información referente a las actividades de validación que realizará la
compañía, donde se definen detalles y escalas de tiempo para cada trabajo de validación a realizar. Las
responsabilidades relacionadas con dicho plan deben ser establecidas.
Procedimiento normalizado
de operación o Procedimiento, al
documento que contiene las instrucciones
necesarias para llevar a cabo de manera reproducible una operación.
Programa de monitoreo ambiental, al establecimiento de una secuencia cronológica de
actividades para evaluar el cumplimiento de los parámetros establecidos de
partículas viables y no viables en un ambiente controlado.
Protocolo, al plan de trabajo escrito que establece los objetivos, procedimientos,
métodos y criterios de aceptación, para realizar un estudio.
Rastreabilidad, a la capacidad de reconstruir la historia, localización
de un elemento o de una actividad,
por medio de registros de identificación.
Robustez, a la capacidad de un proceso de ser insensible, en
cierta medida conocida, a factores que
pudieran afectarlo en las condiciones establecidas.
Sistema contenedor cierre, al conjunto de materiales de empaque que contienen y protegen a
la forma farmacéutica. Incluye tanto al envase primario como al
secundario, si este último cumple la función de proporcionar protección
adicional al producto.
Sistema de gestión de calidad, a la manera como la organización dirige y controla las
actividades asociadas con la calidad.
Validación, a la evidencia documental generada a través de la recopilación y
evaluación de los datos obtenidos en la calificación y de las pruebas
específicas, basadas en conocimiento del proceso, sistema o método, para
demostrar funcionalidad, consistencia y robustez.
Validación concurrente, a la que se realiza durante la fabricación rutinaria de productos
destinados a la comercialización.
Validación de limpieza, a la evidencia documentada de que un procedimiento de limpieza para
las áreas y equipos usados en la fabricación de medicamentos reduce a un
nivel preestablecido los residuos del agente de limpieza y producto
procesado.
Validación prospectiva, a la que se concluye previo a la comercialización de los medicamentos.
5. Símbolos y abreviaturas
% Porcentaje.
± Más menos.
> Mayor que.
Menor o igual que.
Mayor o igual que.
°C Grado Celsius.
KPa kilo pascal.
µm Micrómetro.
m³ Metro cúbico.
mm Milímetro.
Pa Pascal.
BCG Vacuna Bacillus de Calmette Guérin.
BPF Buenas Prácticas de Fabricación.
CAPA Acciones correctivas, acciones preventivas
(por sus siglas en inglés, Corrective Action and Preventive Action).
COFEPRIS Comisión Federal para la Protección
contra Riesgos Sanitarios.
EMSF Expediente Maestro del Sitio de
Fabricación.
FEUM Farmacopea de los Estados Unidos Mexicanos.
HEPA Filtro de aire de alta eficiencia (por sus
siglas en inglés, High Efficiency Particulate Air).
HR Humedad relativa.
HVAC Sistema de aire acondicionado y calefacción
(por sus siglas en inglés, Heating, Ventilation and Air Conditioning).
n.a. No aplica.
PMV Plan maestro de validación.
PNO Procedimiento normalizado de operación.
UFC Unidades formadoras de colonias.
6. Bibliografía
o NOM-059-SSA1-2006. Buenas Prácticas de Fabricación para Establecimientos de la Industria
Químico-farmacéutica dedicadas a la fabricación de medicamentos.
o Procesos de Limpieza y su Validación en Áreas de Fabricación, Primera
Edición, Monografía Técnica N° 16. CIPAM.
o Procedimiento de Limpieza y Sanitización de Áreas de Producción vigente.
o Hisopeo de Trazas para la Liberación de Equipos y Áreas vigente.
o FEUM, Farmacopea de los Estados Unidos Mexicanos. 9a edición.
7. Generalidades
7.1 Principio activo
El
diazepam, principio activo de la especialidad, es un derivado benzodiazepínico
que presenta actividad tranquilizante,
sedante, miorrelajante (relajante muscular), anticonvulsivante (para las convulsiones) y antipsicótica.
Los
médicos recetan este medicamento a personas que padecen ansiedad, agitación y
tensión psíquica debidas a estados psiconeuróticos y trastornos situacionales
transitorios. También lo recetan a pacientes con privación alcohólica, ya que
puede ser útil para el alivio sintomático de la agitación aguda, el temblor y
las alucinaciones.
Además,
se emplea junto con otros medicamentos para el alivio del dolor
músculo-esquelético debido a espasmos (contracturas) o patología local
(inflamación de músculos o articulaciones, traumatismos, etc.). También puede
utilizarse para tratar la espasticidad (rigidez) en afecciones tales como
parálisis cerebral y paraplejia, así como en la atetosis (movimientos
involuntarios) y en el síndrome de rigidez generalizada. También, puede
utilizarse el diazepam junto con otros medicamentos en el tratamiento de los
trastornos convulsivos ya que como tratamiento único no ha demostrado ser útil.
En estos casos, el médico debe evaluar periódicamente la utilidad del medicamento
para cada paciente.
El
diazepam, como todos los fármacos de su clase, actúa deprimiendo la conducción nerviosa en ciertas
neuronas del sistema nervioso central, donde produce desde una leve sedación
hasta hipnosis o coma, en función
de la dosis administrada. Está
indicado para el alivio sintomático de la ansiedad y otros malestares asociados
con el síndrome de ansiedad, incluso los asociados con trastornos
psiquiátricos. Es útil en el tratamiento de espasmos reflejos debidos a traumas locales
(heridas, inflamación). También puede utilizarse para combatir la espasticidad proveniente de daño a las
interneuronas espinales y
supraespinales, como en la parálisis cerebral y
paraplejía, así como en atetosis y
el síndrome del hombro rígido. Las benzodiacepinas sólo están indicadas cuando
el trastorno es severo, inhabilitante o si somete al individuo a un estrés
extremo.
Se considera que su mecanismo de acción consiste en potenciar o facilitar la
acción inhibitoria del neurotransmisor ácido gamma aminobutírico (GABA),
mediador químico de la inhibición tanto en el nivel del botón presináptico como postsináptico, en todas las
regiones del sistema nervioso central.
7.2 Fórmula cuali-cuantitativa
Fórmula para 1000 comprimidos:
Diazepam
………..………….……. 5 g
Piridoxina …………..……….…….
10 g
Lactosa
………………………….….. 100 g
Almidón de trigo
……………….. 58.5 g
Engrudo de almidón
al 10% … c.s.
Almidón de trigo
………………… 7 g
Talco
………………………………….. 7 g
Estereato de
magnesio ……… 3 g
7.3 Diagrama de flujo del proceso de
fabricación
[ver en PDF]
7.4 Descripción del proceso de
fabricación
Se mezclan los
componentes, diazepam, piridoxina, lactosa y almidón de trigo en una mezcladora
cúbica, ajustando la velocidad de giro a 2, y el motor al máximo con una
inclinación de 45º durante media hora. A continuación se humecta la mezcla
anterior con cantidad suficiente de engrudo de almidón al 10% y se granula en
granuladora a través de una placa perforada de 10 mm de diámetro. El granulado
se seca en estufa con circulación de aire a temperatura de 30-35ºC, durante 24
horas. Después, el granulado se homogeniza pasándolo por un tamiz número II (d=
3 mm), se mezcla con el almidón de trigo, talco y estereato de magnesio en el
bombo cilíndrico. Se realiza la compresión con una máquina excéntrica,
utilizando punzones ranurados de 2 y 8 mm de diámetro y regulando la presión a
6.5 ton/cm2.
Consideraciones para el mezclado
·
Verificar que el área de fabricación debe estar limpia y ordenada
a una temperatura menor a 26º C y la humedad relativa menor a 70%.
·
Verificar el nombre, código, número de análisis y peso de las
materias primas descritas en la fórmula cuali-cuantitativa.
Consideraciones para el tableteado
·
El área debe estar limpia y ordenada. No debe existir materia
prima ajena al lote que se va a procesar.
·
Verificar que el área de tableteado se encuentra a una temperatura
de menor a 26 ºC y una humedad relativa menor a 65 %.
·
El personal que está en contacto directo con el producto debe,
utilizar equipo de protección personal: guantes quirúrgicos y mascarillas.
Seguir las normas Buenas Prácticas de Manufactura durante el proceso de
fabricación. Procedimiento GSC -014.
7.5 Etapas críticas
·
La etapa crítica del proceso de fabricación de las tabletas de
·
glibenclamida 5 mg, es la mezcla.
·
El personal debe estar instruido en el monitoreo y registro de los
parámetros de control tales como:
a) Las áreas utilizadas deben estar limpias y
ordenadas. No se debe encontrar productos diferentes al de la fabricación. Los
utensilios deben encontrarse secos y sanitizados.
b) La temperatura y la humedad del área de
fabricación deben registrarse en el formato correspondiente y deben estar
dentro de los rangos establecidos.
c) Durante todo el proceso de fabricación el
personal que está en contacto con el producto debe utilizar los equipos de
protección personal: uniforme blanco, gorro, mascarilla y guantes quirúrgicos,
para evitar su contaminación.
d) En caso de producirse excesiva cantidad de
polvos, utilizar un sistema de extracción adicional de apoyo.
7.6 Equipos
Equipo
|
Detalles
|
|
Balanza 1
|
Marca:
|
Berkel
|
Sensibilidad:
|
0.01 kg
|
|
Capacidad mínima-máxima
|
0.100-9.00 kg
|
|
Balanza 2
|
Marca
|
Bizerba
|
Código
|
BM/AYD 003
|
|
Sensibilidad
|
0.050 kg
|
|
Capacidad máxima
|
97.500 kg
|
|
Capacidad mínima
|
2.500 kg
|
|
Tamizadora eléctrica con malla
|
Marca
|
Siemens Shucker
|
Código
|
02085
|
|
Número de serie
|
1211904
|
|
Kilowatts
|
0.81 kW
|
|
Mezcladora Ortogonal
|
Marca
|
Metal Mecánica SA
|
Código
|
01029
|
|
Capacidad máxima
|
1400 litros
|
|
Numero de motores
|
1
|
|
rpm
|
2.5
|
|
Tableteadora
|
Marca
|
Clit Press CJD4
|
Código
|
01055
|
|
Capacidad máxima
|
95,000 tabletas/hora
|
|
Rpm
|
15000
|
|
Número de motores
|
1
|
|
Etiquetadora
|
Modelo:
|
|
ID:
|
||
Capacidad:
|
||
RPM:
|
||
MOC:
|
||
RPM:
|
||
MOC:
|
||
7.7 Especificaciones de las tabletas
ENSAYOS
|
ESPECIFICACIONES
|
Aspecto
|
Tabletas oblongas con ranura de fragmentación transversal en una de sus
caras
|
Dimensiones
|
Largo: 20.95 mm -21.25 mm
Ancho: 7.30 – 7.35 mm
Altura: 5.65 mm – 6.25 mm
|
Peso promedio
|
200 mg ± 5 %
|
Dureza
|
9-13 kPa
|
Friabilidad
|
Máximo 1 %
|
Desintegración
|
Máximo 30 minutos
|
Agua
|
No mayor de 8.1 %
|
Disolución
|
No menos de 80 %
|
Uniformidad de dosis
|
85 – 115 %
|
Contenido de diazepam por tableta
|
90 – 110 % (5 mg)
|
8. Método de validación
8.1 Datos sobre la calificación de
equipos
Los equipos de
la áreas de control de calidad y producción se encuentra debidamente
calificados ya que cumplen con las especificaciones para su correcto,
funcionamiento, por lo tanto la calificación operacional es conforme.
8.2 Parámetros de controles en
proceso
Fase del granulado sin lubricar
|
Mezcla del
principio activo
|
Tamaño del
gránulo
|
|
Densidad
aparente
|
|
Fase del granulado lubricado
|
Mezcla del
principio activo y de los excipientes
|
Tamaño del
granulado
|
|
Densidad
aparente
|
|
Ángulo de
reposo
|
|
Contenido
de agua
|
|
Fase de compresión
|
Aspecto
|
Dimensiones
|
|
Uniformidad
de peso
|
|
Concentración
de principio activo
|
|
Uniformidad
de contenido de principio activo
|
|
Disolución
|
|
Desintegración
|
|
Dureza
|
8.3 Lotes a controlar
Se requiere de tres
lotes consecutivos con resultados aceptables para considera que el
procedimiento de fabricación de comprimidos de diazepam de 5 mg se considere
validado; si alguno de los tres lotes no es conforme se repetirá la validación
hasta tres veces más para tratar de obtener los resultados consecutivos
aceptables; en caso contrario no se proseguirán las pruebas hasta la revisión
del proceso de fabricación.
8.4 Procedimiento general
Los ensayos se realizan con muestras tomas de
cada uno de los lotes de diazepam de 5 mg en comprimidos cuyo proceso se está
validando.
En general, se
realizará para cada parámetro la toma de muestras que se indica en cada ensayo.
En la fase de granulado sin y con lubricante la toma de muestras se dividirá en
tres (inicio, medio y final del mezclador), en el caso del tableteado, las muestras
se dividen en diez tomas iguales repartidas a lo largo del tiempo de compresión
y recubrimiento (cada 30 minutos en el caso del proceso que se esté evaluando).
8.5 Pruebas en la fase de granulado
sin lubricante
8.5.1 Mezcla de principio activo y
excipientes
Objetivo
Obtener una mezcla homogénea del polvo en el
tiempo especificado.
Criterio
de aceptación
El tiempo
especificado para la mezcla es de 45 minutos en el cual el contenido de diazepam
debe encontrarse en un 90-110%.
Procedimiento
Para determinar el
tiempo de mezcla óptimo para una distribución homogénea del principio activo
con los excipientes se toman tres muestras en tres puntos diferentes del
mezclador (inicio, medio y final) cada 15, 30 y 45 minutos de realizada la
mezcla.
A cada muestra se
analiza el contenido de diazepam.
Resultados
Tabla
1.
Resultados del contenido porcentual de diazepam en la mezcla de polvos, en los
tres lotes.
Lote 1
|
Lote 2
|
Lote 3
|
||
15 minutos
|
Inicio
|
105.32
|
105.04
|
103.32
|
Medio
|
108.63
|
108.63
|
107.43
|
|
Final
|
102.07
|
101.88
|
100.75
|
|
Promedio
|
105.34
|
105.18
|
103.83
|
|
Desviación estándar
|
3.28
|
3.38
|
3.37
|
|
30 minutos
|
Inicio
|
100.87
|
101.54
|
101.43
|
Medio
|
96.99
|
97.62
|
99.78
|
|
Final
|
100.07
|
101.04
|
98.65
|
|
Promedio
|
99.31
|
100.07
|
99.95
|
|
Desviación estándar
|
2.05
|
2.13
|
1.4
|
|
45 minutos
|
Inicio
|
105.11
|
104.12
|
106.72
|
Medio
|
104.31
|
104.88
|
103.43
|
|
Final
|
103.2
|
102.95
|
103.65
|
|
Promedio
|
104.21
|
103.98
|
104.6
|
|
Desviación estándar
|
0.96
|
0.97
|
1.84
|
|
Figura 1. Gráfica
de datos de la tabla anterior tomando los valores promedio en los tiempos 15,
30 y 45 minutos.
Conclusiones
En los análisis
realizados en el granulado sin lubricar se observa que el contenido de daizepam
de 5 mg se encuentra entre 96.99-108.63% y la DSR se encuentra entre
0.96-3.38%, por lo que cumple con lo especificado por la FEUM.
8.5.2 Tamaño del granulado
Objetivo
Comprobar que el
tamaño del gránulo corresponda a las especificaciones establecidas.
Criterio de aceptación
El tamaño del
granulado debe corresponder a lo especificado y en las proporciones de tamaño
establecidas.
Malla 20: máximo 5%
Malla 40: 45-55%
Malla 60:5-10%
Malla 100: 1-5%
Procedimiento
1. Utilizar un agitador tamiz eléctrico con las mallas especificadas, con
una frecuencia de oscilación de 270 ciclos por minutos en un tiempo máximo de
10 minutos.
2. Tomar tres muestras de cada lote (inicio, medio y final) y pasarlas por
los números de malla especificados.
Resultados
Tabla 2.
Distribución porcentual del granulado en la prueba de malla.
Malla
número
|
Lote 1
(%)
|
Lote 2
(%)
|
Lote 3
(%)
|
20
|
4.6
|
3.80
|
3.61
|
40
|
50.1
|
50.70
|
53.20
|
60
|
7.00
|
6.20
|
6.54
|
100
|
2.70
|
1.70
|
1.6
|
BASE
|
34.10
|
35.90
|
34.64
|
Conclusiones
En los análisis
realizados en el granulado lubricado, cumple con lo especificado para la
granulometría de la mezcla.
8.5.3 Densidad aparente
Objetivo
Comprobar que la
densidad del granulado sin lubricar corresponda con lo especificado.
Criterio de aceptación
La densidad
especificada según las normas internas para la mezcla se encuentra en un rango
de 0.7 g/ml – 0.90 g/ml.
Procedimiento
Cada una de las
muestras seleccionadas se analizan por el método de la probeta.
Éste método
consiste en introducir en una probeta calibrada 100 gramos del granulado, se
procede a golpear la probeta 2-3 veces, lo cual hace descender el volumen. Al
final de la operación se mide el volumen aparente. Con el volumen aparente
hallado y con la cantidad de muestra tomada se halla la densidad aparente.
Resultados
Tabla 3.
Densidad aparente de los tres lotes de gránulos sin lubricante de diazepam.
Toma de muestras
|
Lote 1
(g/ml)
|
Lote 2
(g/ml)
|
Lote 3
(g/ml)
|
Inicio
|
0.8031
|
0.8213
|
0.8332
|
Medio
|
0.8122
|
0.8214
|
0.822
|
Final
|
0.8120
|
0.8220
|
0.8125
|
Promedio
|
0.8091
|
0.8216
|
0.8193
|
DSR
|
0.0052
|
0.0004
|
0.0059
|
Conclusiones
En los ensayos
realizados en el granulado sin lubricante se observa que los resultados cumplen
con las especificaciones establecidas, obteniéndose densidades desde 0.8031
g/ml hasta 0.8232 g/ml.
8.6 Pruebas en la fase de granulado
con lubricante
8.6.1 Mezcla de principio activo y
excipientes
Objetivo
Obtención de una
mezcla homogénea del polvo en el tiempo especificado.
Criterio de aceptación
El tiempo
especificado para la distribución homogénea de lubricante es de 15 minutos en
el cual el contenido de diazepam debe encontrarse en un 90-110% y el contenido
de estereato de magnesio debe encontrarse entre 0.60-0.80 %.
Procedimiento
Para determinar el
tiempo de mezcla óptimo para una distribución homogénea del principio activo
con los excipientes se toman tres muestras en tres puntos diferentes del
mezclador (inicio, medio y final) cada 5, 10 y 15 minutos de realizada la
mezcla.
A cada muestra se
analiza el contenido de diazepam.
Resultados
Tabla
4.
Porcentaje de contenido de diazepam en los gránulos lubricados.
Lote 1
|
Lote 2
|
Lote 3
|
||
15 minutos
|
Inicio
|
105.32
|
105.04
|
103.32
|
Medio
|
108.63
|
108.63
|
107.43
|
|
Final
|
102.07
|
101.88
|
100.75
|
|
Promedio
|
105.34
|
105.18
|
103.83
|
|
Desviación estándar
|
3.28
|
3.38
|
3.37
|
|
30 minutos
|
Inicio
|
100.87
|
101.54
|
101.43
|
Medio
|
96.99
|
97.62
|
99.78
|
|
Final
|
100.07
|
101.04
|
98.65
|
|
Promedio
|
99.31
|
100.07
|
99.95
|
|
Desviación estándar
|
2.05
|
2.13
|
1.4
|
|
45 minutos
|
Inicio
|
105.11
|
104.12
|
106.72
|
Medio
|
104.31
|
104.88
|
103.43
|
|
Final
|
103.2
|
102.95
|
103.65
|
|
Promedio
|
104.21
|
103.98
|
104.6
|
|
Desviación estándar
|
0.96
|
0.97
|
1.84
|
|
Figura 2. Gráfica
de la tabla anterior tomando los valores promedio.
Conclusiones
En los análisis
realizados en el granulado sin lubricar se observa que el contenido de daizepam
de 5 mg se encuentra entre 96.99-108.63% y la DSR se encuentra entre
0.96-3.38%, por lo que cumple con lo especificado por la FEUM.
8.6.2 Tamaño del granulado
Objetivo
Comprobar que el
tamaño del gránulo corresponda a las especificaciones establecidas.
Criterio de aceptación
El tamaño del
granulado debe corresponder a lo especificado y en las proporciones de tamaño
establecidas.
Malla 20: máximo 5%
Malla 40: 45-55%
Malla 60:5-10%
Malla 100: 1-5%
Procedimiento
1. Utilizar un agitador tamiz eléctrico con las mallas especificadas, con
una frecuencia de oscilación de 270 ciclos por minutos en un tiempo máximo de
10 minutos.
2. Tomar tres muestras de cada lote (inicio, medio y final) y pasarlas por
los números de malla especificados.
Resultados
Tabla 5.
Distribución porcentual del granulado en la prueba de malla.
Malla
número
|
Lote 1
(%)
|
Lote 2
(%)
|
Lote 3
(%)
|
20
|
4.6
|
3.80
|
3.61
|
40
|
50.1
|
50.70
|
53.20
|
60
|
7.00
|
6.20
|
6.54
|
100
|
2.70
|
1.70
|
1.6
|
BASE
|
34.10
|
35.90
|
34.64
|
Conclusiones
En los análisis
realizados en el granulado lubricado, cumple con lo especificado para la
granulometría de la mezcla.
8.6.3 Densidad aparente
Objetivo
Comprobar que la
densidad del granulado lubricado corresponda con lo especificado.
Criterio de aceptación
La densidad
especificada según las normas internas para mezcla se encuentra en un rango de
0.70 g/ml – 0.90 g/ml.
Procedimiento
Cada una de las
muestras seleccionadas se analizan por el método de la probeta.
Éste método
consiste en introducir en una probeta calibrada 100 gramos del granulado, se
procede a golpear la probeta 2-3 veces, lo cual hace descender el volumen. Al
final de la operación se mide el volumen aparente. Con el volumen aparente
hallado y con la cantidad de muestra tomada se halla la densidad aparente.
Resultados
Tabla
6.
Densidad aparente de las muestras de granulado de diazepam que contenían
lubricante usando el método de la probeta.
Toma de muestras
|
Lote 1
(g/mL)
|
Lote 2
(g/mL)
|
Lote 3
(g/mL)
|
Inicio
|
0.8123
|
0.8123
|
0.8123
|
Medio
|
0.8116
|
0.8116
|
0.8116
|
Final
|
0.8263
|
0.8263
|
0.8263
|
Promedio
|
0.8117
|
0.8117
|
0.8117
|
DSR
|
0.0082
|
0.0062
|
0.0040
|
Conclusiones
En los ensayos
realizados en el granulado lubricado se observa que los resultados cumplen con
las especificaciones establecidas, obteniéndose densidades desde 0.8116 hasta
0.8263 g/ml.
8.6.4 Ángulo de reposo
Objetivo
Comprobar que el
ángulo de reposo de la mezcla se encuentre dentro de lo especificado.
Criterio de aceptación
De acuerdo con lo
especificado el ángulo de reposo debe ser de 25-45º.
Procedimiento
1. Tomar una muestra de 20 g de granulado.
2. Deslizar la muestra a través de un embudo de dimensiones normalizadas y
medir el ángulo de la base de la pirámide formada por el producto.
Resultados
Tabla 7. Ángulo
de reposo de los granulados de diazepam con lubricantes.
Toma de muestras
|
Lote A
|
Lote B
|
Lote C
|
Inicio
|
36
|
36
|
36
|
Medio
|
35
|
36
|
36
|
Final
|
36
|
34
|
35
|
Promedio
|
35.67
|
35.53
|
35.67
|
Conclusiones
En los resultados
obtenidos se observa que el ángulo de reposo de la mezcla se encuentra entre
34-36º los cuales se encuentran dentro de las especificaciones establecidas.
8.7 Pruebas en la fase de tableteado
8.7.1
Aspecto
Objetivo
Comprobar que el aspecto de los comprimidos
corresponda con las especificaciones establecidas.
Criterio
de aceptación
Los comprimidos
deben ser oblongos de color blanco con ranura de fragmentación transversal en
una de sus caras.
La clasificación de
defectos en las tabletas durante el proceso de manufactura son:
Defectos críticos:
·
Evidencia de partículas metálicas
o sustancias consideradas tóxicas (grasas, colorantes extraños a la fórmula…)
·
Evidencia de presencia de material
extraño que afecte la pureza, seguridad y potencia del producto.
·
Tabletas con manchas o marcas en
la superficie mayores de 1 mm.
Defectos mayores
I:
·
Tabletas rotas, laminadas,
partidas, con puntos negros, tabletas muy frágiles.
Defectos mayores
II:
·
Tabletas con bordes irregulares,
superficie ligeramente agrietada, porosa, raspada.
·
Tabletas con marcas, manchadas,
moteadas, puntos negros o con defectos significativos en su superficie.
Defectos
menores:
·
Tabletas con manchas (puntos
negros) menores de 0.3 mm
·
Tableas con bordes defectuosos
apenas perceptibles.
De 100 tabletas
inspeccionadas, deben cumplir con lo siguiente:
Defectos críticos
|
Ninguna unidad defectuosa
|
Defectos mayores I
|
Ninguna unidad defectuosa
|
Defectos mayores II
|
No más de 2.5% de unidades defectuosas.
|
Defectos menores
|
No más de 7.0% de unidades defectuosas.
|
Defectos mayores + menores
|
No más de 5.0% de unidades defectuosas.
|
Procedimiento
a)
Tomar 50 unidades de la máquina
tableteadora en operación.
b) Observar visualmente cada tableta y anotar los defectos encontrados
comparándolos frente a las especificaciones establecidas.
c) Registrar la información obtenida.
Resultados
Tabla
8.
Resultados de la inspección visual de 50 tabletas de cada lote al inicio y al
final del proceso de tableteado.
Lote
|
Tamaño de muestra
|
Crítico
|
Mayor I
|
Mayor II
|
Menor
|
Resultado
|
A1
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
AII
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
BI
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
BII
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
CI
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
CII
|
50
|
0
|
0
|
0
|
0
|
Aprobado
|
Conclusiones
Los comprimidos cumplen con las
especificaciones establecidas.
8.7.2
Dimensiones
Objetivo
Comprobar que las
dimensiones de las tabletas cumplen con las especificaciones establecidas.
Criterio
de aceptación
Las dimensiones establecidas para las tabletas
de diazepam de 5 mg son:
Largo: 20.95-21.25 mm
Ancho: 7.30-7.35 mm
Altura: 5.65-6.25
Procedimiento
a)
Tomar 50 unidades de la máquina
tableteadora en operación.
b)
La medida de los núcleos se
realizará con el calibrador Pie de rey de un rango de medición de 150 mm,
división mínima de 0.05 mm.
c)
Registrar la información obtenida
en el registro de manufactura.
Resultados
Tabla
9.
Variación en grosor de las tabletas de diazepam 5 mg. El grosor deseado fue de
7.5 mm.
S. NO.
|
Lote 1
|
Lote 2
|
Lote 3
|
1
|
7.52
|
7.54
|
7.56
|
2
|
7.53
|
7.42
|
7.35
|
3
|
7.36
|
7.49
|
7.45
|
4
|
7.55
|
7.5
|
7.42
|
5
|
7.39
|
7.53
|
7.49
|
6
|
7.58
|
7.58
|
7.55
|
Promedio
|
7.51
|
7.51
|
7.5
|
Mínimo
|
7.3
|
7.3
|
7.3
|
Máximo
|
7.8
|
7.8
|
7.8
|
Figura 3.
Resultados de la variación en grosor de las tabletas de diazepam de la tabla
anterior.
Conclusiones
En los comprimidos tomados para el ensayo se
observa que las dimensiones de largo, ancho y altura cumplen con las
especificaciones establecidas.
8.7.3
Uniformidad de peso
Objetivo
Comprobar que el
peso de los comprimidos corresponde con el peso establecido en las
especificaciones.
Criterio
de aceptación
El peso establecido del núcleo es 200 mg ± 5%.
El peso individual
de no más de dos unidades se puede desviar del peso promedio en un 5% pero el
peso de ninguna unidad puede desviarse más del doble de éste porcentaje.
Procedimiento
Se toman veinte
tabletas al azar seleccionadas de cada lote y se calcula su promedio. Los pesos
individuales se comparan con el peso promedio. El porcentaje de diferencia de
variación en peso debe estar dentro de los límites permisibles.
Resultados
Tabla
10.
Resultados de la evaluación de la uniformidad de peso de las tabletas de
diazepam 5 mg.
S. No
|
Lote 1
|
Lote 2
|
Lote 3
|
1
|
205.1
|
190.9
|
199.6
|
2
|
190.4
|
190.2
|
197.6
|
3
|
210.0
|
199.8
|
195.3
|
4
|
193.1
|
205.1
|
190.9
|
5
|
195.1
|
204.9
|
195.3
|
6
|
199.6
|
202.7
|
206.9
|
7
|
190.2
|
203.1
|
206.2
|
8
|
190.4
|
203.6
|
207.1
|
9
|
204.7
|
205.6
|
208.4
|
10
|
205.1
|
206.0
|
208.2
|
11
|
200.0
|
207.8
|
202.9
|
12
|
200.2
|
210.0
|
205.3
|
13
|
202.7
|
200.0
|
207.6
|
14
|
202.9
|
203.3
|
204.7
|
15
|
201.1
|
202.0
|
210.0
|
16
|
201.8
|
200.2
|
202.0
|
17
|
202.2
|
198.9
|
200.9
|
18
|
204.4
|
197.1
|
201.8
|
19
|
190.9
|
192.2
|
202.9
|
20
|
200.0
|
204.2
|
203.3
|
Mínimo
|
190.00
|
190.00
|
190.00
|
Máximo
|
212.00
|
210.00
|
210.00
|
Promedio
|
199.50
|
201.38
|
202.84
|
Figura 4. Variación en peso de diazepam 5
mg. Datos de la tabla anterior.
Conclusiones
Los pesos de los
comprimidos tomados para el ensayo cumplen con las especificaciones
establecidas.
8.7.4
Concentración del principio activo
Objetivo
Comprobar que el contenido de principio activo
en los comprimidos es lo especificado y es uniforme.
Criterio
de aceptación
De acuerdo a la FEUM
en un análisis de 10 unidades, las 10 unidades deben contener de 85-115% de
principio activo y la DSR debe ser menor o igual a 6%.
Resultados
Tabla 11.
Variación porcentual en el contenido de diazepam en los comprimidos de 5 mg.
Muestra
|
Lote 1
|
Lote 2
|
Lote 3
|
1
|
101.5
|
100.2
|
101.3
|
2
|
101.1
|
102.6
|
99.5
|
3
|
99.4
|
99.1
|
100.7
|
4
|
103.4
|
100.7
|
103.5
|
5
|
105
|
102.9
|
104.8
|
6
|
101.4
|
100.6
|
100.8
|
7
|
101.5
|
100.9
|
101.3
|
8
|
101.1
|
103.8
|
103
|
9
|
103
|
102.1
|
101.5
|
10
|
101.5
|
100.5
|
101.3
|
Promedio
|
101.9
|
101.3
|
101.8
|
DSR
|
1.5
|
1.4
|
1.6
|
Figura 5.
Variación porcentual en el contenido de diazepam en los tres lotes (unidades eje "y" son %).
Conclusiones
La uniformidad de
dosis obtenida en los ensayos es de 99.1% a 105.0%, los cuales se encuentran
dentro del rango especificado según la FEUM.
8.7.5
Disolución
Objetivo
Comprobar que la
velocidad de disolución de los comprimidos de las tabletas correspondan a lo
especificado.
Criterio
de aceptación
De acuerdo a ala FEUM en un análisis de 6
tabletas, las 6 deben liberar no menos que el 80% de diazepam en 30 minutos.
Procedimiento
Se colocan seis
tabletas en matraces de disolución que contienen 900 ml de HCl, pH=2.0,
previamente mantenido a 37 ± 0.5 ºC. La canasta se coloca a 50 rpm por 60
minutos. Una muestra significativa se extrae en intervalos de tiempo y se
filtra a través de una membrana de 0.45 µm de diámetro. Se mide la absorbancia
de las muestra a 249 nm, usando HCl pH=2.0 como blanco.
Resultados
Tabla
12. Perfil
de disolución de comprimidos de diazepam de 5 mg. Porcentaje de diazepam
disuelto. Máximo permisible, 30 minutos.
Lote
|
Tableta
|
5 min
|
10 min
|
15 min
|
30 min
|
45 min
|
60 min
|
1
|
Tableta 1
|
10
|
28
|
45
|
82
|
89
|
95
|
Tableta 2
|
12
|
31
|
48
|
83
|
90
|
96
|
|
Tableta 3
|
14
|
33
|
50
|
85
|
92
|
98
|
|
Tableta 4
|
16
|
35
|
51
|
88
|
93
|
97
|
|
Tableta 5
|
15
|
32
|
50
|
84
|
90
|
94
|
|
Tableta 6
|
18
|
30
|
56
|
89
|
95
|
98
|
|
2
|
Tableta 1
|
12
|
25
|
40
|
86
|
90
|
93
|
Tableta 2
|
18
|
32
|
48
|
84
|
95
|
96
|
|
Tableta 3
|
14
|
36
|
42
|
82
|
91
|
94
|
|
Tableta 4
|
16
|
38
|
52
|
87
|
96
|
97
|
|
Tableta 5
|
15
|
34
|
58
|
86
|
94
|
95
|
|
Tableta 6
|
19
|
39
|
54
|
85
|
96
|
98
|
|
3
|
Tableta 1
|
11
|
24
|
41
|
82
|
89
|
91
|
Tableta 2
|
15
|
30
|
42
|
85
|
91
|
95
|
|
Tableta 3
|
16
|
32
|
45
|
84
|
90
|
92
|
|
Tableta 4
|
12
|
34
|
53
|
86
|
94
|
96
|
|
Tableta 5
|
15
|
38
|
57
|
87
|
93
|
98
|
|
Tableta 6
|
19
|
35
|
52
|
84
|
90
|
97
|
Figura 6. % de
perfil de disolución de diazepam
Conclusiones
Los comprimidos
liberan de 82.2-84.5 % de diazepam en menos de 30 minutos, lo cual se encuentra
dentro de lo especificado por la FEUM.
8.7.6
Disgregación
Objetivo
Comprobar que el tiempo requerido para la
disgregación del comprimido no es mayor al tiempo especificado.
Criterio
de aceptación
El tiempo
especificado para la desintegración debe ser menor a 30 minutos. Si de un
análisis de 6 tableteas, 1 o 2 no se desintegran, se repite la prueba con 12
unidades. De lsa 18 tabletas, 16 tienen que haberse disgregado.
Procedimiento
Se usa el aparato
de la RFE tipo Erweka ZT2. El ensayo se realiza con 6 comprimidos y se
considera que el ensayo es satisfactorio cuando no quedan residuos sobre la
rejilla, y si quedara residuo que sea lo formado por una masa blanda que no
constituye un núcleo palpable. Todos los comprimidos deben desintegrarse en 30
minutos, si uno o dos no se han disgregado, se repite el ensayo con 12
comprimidos más. Del total de 18, un mínimo de 16 debe desintegrase totalmente
en el tiempo estipulado.
Conclusiones
Se puede afirmar que fue satisfactorio ya que
los resultados obtenidos indican que los comprimidos verifican las
especificaciones impuestas por la RFE, pues el 50% se disgregan en 3 minutos y
el resto a los 4 minutos.
8.7.7 Dureza
Objetivo
Comprobar que la dureza del comprimido cumpla
con las especificaciones establecidas.
Criterios
de aceptación
La dureza debe ser de 9-13 kPa.
Procedimiento
Se determina la
dureza con un aparato tipo Erweka TBH 20. El ensayo se efectúa sobre 10 comprimidos,
determinando los valores medios, mínimos y máximos de las fuerzas medidas,
expresadas en kPa.
Resultados
Tabla
13.
Variación en la dureza de tabletas de diazepam 5 mg reportados en kg/cm2.
El deseado fue de 9-13.
S. NO.
|
Lote 1
|
Lote 2
|
Lote 3
|
1
|
10.02
|
9.5
|
10.67
|
2
|
9.46
|
10
|
11.21
|
3
|
9.52
|
11
|
9.59
|
4
|
10.7
|
9.09
|
9.89
|
5
|
10
|
9.8
|
10.58
|
6
|
11
|
10.02
|
11.07
|
Promedio
|
10.1
|
9.9
|
10.5
|
Mínimo
|
9
|
9
|
9
|
Máximo
|
13
|
13
|
13
|
Figura 7.
Variación en dureza. Datos de la tabla anterior.
Conclusiones
La dureza fue de 9.46-11.07 kPa, por lo que
cumple con lo especificado.
8.7.8
Friabilidad
Objetivo
Comprobar que el
núcleo es capaz de soportar el desgaste.
Criterio de aceptación
Según la FEUM, la
pérdida de peso de los núcleos no debe ser mayor al 1 %. Si la pérdida de peso
es mayor al 1 % la prueba debe repetirse dos veces más. El promedio de las tres
determinaciones no debe ser mayor a 1 %.
Procedimiento
Se emplea el Erweka
TAP con 20 comprimidos previamente desempolvados y pesados con precisión.
Frecuencia: Mínimo
dos veces durante el proceso. Una muestra se realiza al iniciar el proceso de
fabricación y otra a la mitad.
Resultados
Toma de muestras
|
Friabilidad
|
||
Lote A
|
Lote B
|
Lote C
|
|
1
|
|||
2
|
|||
3
|
|||
4
|
|||
Promedio
|
|||
D.S.R.
|
|||
Conclusiones
Los resultados obtenidos fueron
satisfactorios, pues se obtuvo una friabilidad del 0.26 %, notablemente
inferior a la máxima permitida por la RFE (1%).
8.8 Análisis estadístico
Los datos se
procesaron en el paquete estadístico SPSS versión 11.10 para Windows para
obtener los cuadros estadísticos, construyéndose tablas descriptivas para las
variables en estudio. Estos últimos exponen el resultado de la información que
se recopiló y se utilizó para hacer el análisis de los datos.
Para el procesamiento
de los datos se procedió de la siguiente manera:
·
Estadígrafos de las variables.
·
Se realizó pruebas de T-student para hallar diferencias entre las
medias de variación de cada parámetro.
·
Se realizó el análisis de varianza para cada variable.
·
Se realizó pruebas de Pearson para correlacionar las variables.
·
Se realizó el análisis de regresión lineal con su respectiva
ecuación de regresión.
·
Se utilizó la prueba de Kolgomorov Smirlov para evaluar la
homogeneidad de la mezcla.
Tamaño
de muestra
Donde:
n= tamaño de muestra
Z= distribución normal
P= probabilidad de éxito
Q= probabilidad de fracaso
D= error de muestra
8.9 Estudio de capacidad
Se realiza para determinar la
reproducibilidad del proceso en forma consistente. Se basa en el cálculo de
distintos índices los cuales ocupan la información entregada por los valores de
media y desviación estándar.
-Índice de Capacidad del Proceso (Cp):
establece una relación entre los límites de especificación (LES y LEI) y la
variabilidad del proceso, sin embargo, no señala si el proceso cumple con esas
especificaciones, ya que no se refiere al valor medio de éste. Se puede
establecer el Índice de Capacidad del Proceso Superior (Cps) e Inferior (Cpi),
para casos en que se cuenta sólo con un límite de especificación; para estos
casos, los criterios de aceptación son distintos a los procesos que cuentan con 2 especificaciones.
Cp = (LES- LEI) / 6σ
Cps = (LES – µ ) / 3σ
Cpi = ( µ – LEI ) / 3σ
LES = Límite de Especificación Superior
LEI = Límite de Especificación Inferior
-Índice de Rendimiento o Capacidad Real
(Cpk): es una modificación del Cp, con el fin de evaluar la ubicación de la
media con respecto a los límites de especificación.
Cpk = MC/3σ
Donde MC es el valor más pequeño entre
(LES-µ) y (µ –LEI). Si la media del proceso corresponde al valor nominal de la
especificación, Cpk es igual a Cp, es decir, el proceso se encuentra
completamente centrado, de lo contrario, siempre será menor. El problema que
surge a partir de este índice es la cuantificación de la centralización, ya que
es un índice estricto y sólo indica si la media del proceso está centrada o no.
Se debe recalcar que un proceso no centrado, no necesariamente está fuera de
las especificaciones
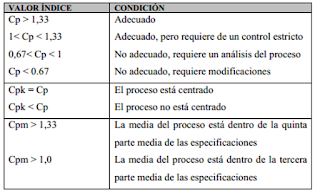
En términos generales, se pueden
mencionar los valores adecuados de estos índices en la siguiente tabla:
Resumen de Índices de Capacidad del Proceso
9. Informe técnico
Las operaciones de validación del proceso de
fabricación de comprimidos de diazepam de 5 mg han sido verificadas por el
equipo de validación, siguiendo cada uno de los pasos indicados en el
protocolo.
Prueba
|
Especificación
|
Resultado
|
Conclusión
|
Homogenidad
principio activo y excipiente antes de añadir lubricante
|
Contenido de diazepam 90-100% antes de los 45 minutos.
|
96.99-108.63 % a los 45 minutos.
|
Aprobado
|
Tamaño
del granulado
|
Malla 20: máximo 5%
Malla 40: 45-55%
Malla 60: 5-10%
Malla 100: 1-5%
|
Malla 20: 3.80 %
Malla 40: 50.70 %
Malla 60: 6.20%
Malla 100: 1.7 %
Base: 35.90 %
|
Aprobado
|
Densidad
aparente
|
0.7-0.9 g/ml
|
0.8031-0.8233 g/ml
|
Aprobado
|
Homogenidad
|
Antes de 15 minutos el contenido de diazepam debe ser
de 90-110%
|
96.99-108.63% antes de los 15 minutos.
|
Aprobado
|
Densidad
aparente
|
0.70-0.90 g/ml
|
0.8116-0.8263 g/ml
|
Aprobado
|
Ángulo
de reposo
|
25-45º
|
34-36º
|
Aprobado
|
Aspecto
|
Defectos críticos: Ninguna
Defectos mayores I: Ninguna
Defectos mayores II: No más del 2.5%
Defectos menores: No más del 7.0%
Defectos mayores + menores: No más del 5.0%
|
Defectos críticos: Ninguna
Defectos mayores I: Ninguna
Defectos mayores II: Ninguna
Defectos menores: Ninguna
Defectos mayores + menores: Ninguna
|
Aprobado
|
Dimensiones
|
Largo: 20.95-21.25 mm
Ancho: 7.30-7.35 mm
Altura: 5.65-6.25
|
Largo: 20.98-21.02 mm
Ancho: 7.33-7.35 mm
Altura: 5.75-6.10
|
Aprobado
|
Uniformidad
de peso
|
200 mg ± 5%
|
190.15-208.9 mg
|
Aprobado
|
Concentración
de principio activo
|
85-115% API
DSR menor a 6%
|
99.1%-105.0% API
DSR= 1.5%
|
Aprobado
|
Disolución
|
No menos que el 80% de diazepam en 30 minutos
|
82.2-84.5% del diazepam en menos de 30 minutos.
|
Aprobado
|
Disgregación
|
Menor a 30 minutos
|
Más del 50% a los 3 minutos
El resto a los 4 minutos
|
Aprobado
|
Dureza
|
9-13 kg/cm2
|
9.46-11.07 kg/cm2
|
Aprobado
|
Friabilidad
|
Menor a 1 %
|
0.26%
|
Aprobado
|








No hay comentarios:
Publicar un comentario
Deja tu comentario, puede ser anónimo. Todos son bienvenidos.