Objetivos
·
Definir e
identificar la importancia de las propiedades: densidad, viscosidad e índice de
refracción en soluciones acuosas.
·
Determinar
experimentalmente la relación de la densidad, la viscosidad e índice de
refracción con la concentración de algunas soluciones.
·
Demostrar
qué factores pueden modificar dichas propiedades
·
Relacionar
cuál es la importancia de estas propiedades en la industria farmacéutica,
indicando ejemplos de aplicación.
Introducción
Densidad.
La densidad p de una
sustancia es la masa que corresponde a un volumen unidad de dicha sustancia. Su
unidad en el SI es el cociente entre la unidad de masa y la del volumen, es
decir kg/m3 o kg · m-3.
A diferencia de la masa o el volumen, que dependen de cada objeto, su
cociente depende solamente del tipo de material de que está constituido y no de
la forma ni del tamaño de aquél. Se dice por ello que la densidad es una
propiedad o atributo característico de cada sustancia. En los sólidos la
densidad es aproximadamente constante, pero en los líquidos, y particularmente
en los gases, varía con las condiciones de medida. Así en el caso de los
líquidos se suele especificar la temperatura a la que se refiere el valor dado
para la densidad y en el caso de los gases se ha de indicar, junto con dicho
valor, la presión (Chang, et. al.,
2008).
Viscosidad.
La viscosidad es
una medida de la resistencia de los líquidos a fluir. Cuanto más viscoso es un
líquido, más lento es su flujo. La viscosidad de un líquido suele disminuir con
el aumento en la temperatura, por esta razón la melaza caliente fluye más
rápido que cuando está fría.
Los líquidos con
fuerzas intermoleculares fuertes son más viscosos que los que tienen fuerzas
intermoleculares débiles. El agua tiene
mayor viscosidad que muchos otros Líquidos por su capacidad para formar enlaces
de hidrógeno (Bird, et. al.,
2006).
Índice de refracción.
Refractómetro de Abbe.- Su función es
medir el índice de refracción de
una muestra líquida (o sólida si tiene una cara lisa y pulida).
Las dos partes principales del
instrumento son el prisma de
iluminación y el prisma de
refracción. En óptica, un prisma es un objeto capaz de reflejar y/o
refractar la luz. La
refracción de la luz consiste en su cambio de dirección al cambiar de medio. Pero el
cambio de dirección depende de la longitud de onda de la luz, y como la luz
blanca que llega al prisma es una mezcla de radiaciones de diferentes
longitudes de onda, cada una se difracta (es decir, cambia de dirección) en
grado diferente (Connors, et. al.,
1980 ).
Para mediar el índice de refracción de un líquido en un
refractómetro Abbe se ponen unas gotas de la muestra sobre la cara horizontal
del prisma de refracción. Después, este prisma se cubre con el de iluminación
(que es abatible, como se observa en la primera figura). Con esto se consigue
una finísima película de muestra que queda entre ambos prismas, como se ve en
la imagen siguiente:
Desarrollo experimental
Resultados
Tabla
1. Masas de las soluciones de etanol a diferentes
concentraciones utilizando el picnómetro. mw=9.7354 g
Concentración
de etanol (%)
|
mp
(g)
|
Mps
(g)
|
ms
(g)
|
densidad
relativa
|
10
|
18.5794
|
28.155
|
9.5756
|
0.9835
|
30
|
18.5726
|
27.9185
|
9.3459
|
0.9599
|
50
|
18.586
|
27.6701
|
9.0841
|
0.9330
|
70
|
18.5654
|
27.1739
|
8.6085
|
0.8842
|
90
|
18.575
|
26.6109
|
8.0359
|
0.8254
|
Figura
1. Gráfica de la concentración de etanol (%) contra la
densidad relativa de la solución. Se observa una tendencia inversamente
proporcional a la concentración de etanol. Densidad etanol 20ºC= 0.791 g/cm3,
Densidad del agua 20ºC= 0.998 g/cm3
Tabla
2. Masa de las soluciones de sacarosa a diferentes
concentraciones usando el picnómetro. mw=9.7354 g
Concentración
|
mps
|
ms
|
densidad
relativa
|
0.1
|
30.3041
|
10.1713
|
1.0091
|
0.2
|
30.3966
|
10.2638
|
1.0182
|
0.3
|
30.4863
|
10.3535
|
1.0271
|
0.4
|
30.5856
|
10.4528
|
1.0370
|
0.5
|
30.6836
|
10.5508
|
1.0467
|
Figura 2. Densidad relativa de
las soluciones de sacarosa respecto a la concentración molar de ésta.
Tabla 3. Tiempos de flujo y viscosidad del etanol a diferentes concentraciones
para el método de Ostwald. tw= 90 segundos
Conc.
Etanol (%)
|
t
Et (1)
(s)
|
t
Et (2)
(s)
|
t
Et prom
(s)
|
Densidad relativa
|
Viscosidad
Kg/m*s
|
10
|
126
|
124
|
125
|
0.9835
|
0.00136609
|
30
|
208
|
209
|
208.5
|
0.9599
|
0.00222398
|
50
|
252
|
253
|
252.5
|
0.9330
|
0.00261786
|
70
|
233
|
234
|
233.5
|
0.8842
|
0.00229413
|
90
|
195
|
194
|
194.5
|
0.8254
|
0.00178385
|
*Viscosidad etanol a 20ºC=1.20x10-2
P (dina*s/cm3) = 1.20x10-3 kg/ms
*Viscosidad agua a 20ºC= 1.0x10-2 P
(dina*s/cm3) = 1.0x10-3 kg/ms
Figura
3. Viscosidad de la mezcla de etanol-agua a diferentes
concentraciones usando el método de Ostwald.
Tabla 4.
Tiempos de flujo y densidad relativa de las diferentes
disoluciones de sacarosa en agua para el cálculo de viscosidad por el método de
Ostwald. tw=55.87 s
Concentración
M
|
t1
(s)
|
densidad
relativa
|
Viscosidad
Kg/ms
|
0.1
|
50.845
|
1.0091
|
0.00091836
|
0.2
|
62.1
|
1.0182
|
0.00113184
|
0.3
|
65.85
|
1.0271
|
0.00121068
|
0.4
|
68.99
|
1.0370
|
0.00128058
|
0.5
|
74.385
|
1.0467
|
0.00139366
|
Figura
4. Viscosidad de la mezcla sacarosa-agua a diferentes
concentraciones usando el método de Ostwald. Se observa una tendencia lineal (véase discusión).
Tabla 5. Características de las esferas usadas en el método de la esfera caída
para determinación de la viscosidad
Esfera
|
Diámetro
(mm)
|
Peso
(g)
|
Densidad
esfera
(g/cm3)
|
medio
|
1
|
2.6
|
0.0344
|
3.7379
|
Propilenglicol
|
2
|
2.5
|
0.0281
|
3.4346
|
Propilenglicol
|
3
|
2.8
|
0.0337
|
2.9319
|
Glicerina
|
4
|
2.5
|
0.0322
|
3.9358
|
Glicerina
|
Tabla 6. Determinación de viscosidad por el método de la esfera caída
solución
|
distancia
(m)
|
t1
(s)
|
t2
(s)
|
t
prom
(s)
|
V
(m/s)
|
Viscosidad
(kg/ms)
|
Glicerina
|
0.515
|
141.97
(3)
|
115.82
(4)
|
128.895
|
0.0039955
|
2.081
|
Propilenglicol
|
0.454
|
7.76
(1)
|
7.29
(2)
|
7.525
|
0.06033223
|
0.151
|
Tabla 7. Datos de las densidades relativas e índices de refracción de las
disoluciones de etanol a diferentes concentraciones
Conc.
Etanol
(%)
|
densidad
relativa
|
índice
de refracción
|
10
|
0.9835
|
1.339
|
30
|
0.9599
|
1.35
|
50
|
0.9330
|
1.357
|
70
|
0.8842
|
1.364
|
90
|
0.8254
|
1.365
|
*Índice de refracción del agua pura=1.333
(medido), IR etanol puro=1.361 (reportado)
Figura
5. Variación del índice de refracción de las
diferentes muestras de etanol-agua respecto a la concentración. Regresión
lineal: IR=0.0003*C + 1.3385, r2=0.9348, IR(0%, agua pura)=1.3385,
IR(100%, etanol puro)=1.3685
Tabla 8. Datos de densidades relativas e índices de refracción de las diferentes
concentraciones de sacarosa-agua.
Concentración
sacarosa (M)
|
densidad
relativa
|
IR
|
0.1
|
1.00911761
|
1.334
|
0.2
|
1.01829474
|
1.336
|
0.3
|
1.02719408
|
1.34
|
0.4
|
1.03704586
|
1.3435
|
0.5
|
1.04676866
|
1.351
|
Figura 6. Variación del índice
de refracción de las diferentes concentraciones de sacarosa-agua. Regresión
lineal: IR=0.0415*C + 1.3285, r2=0.9505, IR(0 M, agua pura)=1.3385,
IR(sacarosa)=1.399 (20ºC).
Discusión
En las figuras 1 y
2 se observa una tendencia lineal en la densidad respecto a la concentración de
las soluciones de etanol y sacarosa, respectivamente. En la Figura 1 la
tendencia de la densidad es inversamente proporcional a la concentración de
etanol, hecho que concuerda con lo esperado, ya que los límites C(0%, 100%)
tienden a las concentraciones de las sustancias puras, de 0.997 g/mL y 0.791
g/mL para agua y etanol. Por el contrario, la figura 2 muestra una tendencia
directamente proporcional (con una pendiente positiva) que indica que entre
mayor sea la concentración de sacarosa mayor será la densidad de la mezcla (𝜌sacarosa>𝜌agua), lo que concuerda con lo esperado, pues la sacarosa (1.58 g/mL)es más
densa que el agua.
Figura 7. Índice de refracción y
densidad relativa de diferentes soluciones de sacarosa reportadas en la
bibliografía (Heidcamp, et. al., 2010).
Se pueden comparar las pendientes y ordenadas al origen obtenidas respecto a
las esperadas. Para el índice de
refracción se tiene mteórico=0.0489 mexperimental=0.0415
(E=15%), bteórico=1.333, bexperimental=1.3285 (E=0.3%).
Para la densidad se tiene mteórico=0.0489, mexperimental=0.0941
(E=92%), bteórico=0.9983, bexperimental=0.9995 (E=0.12%).
Figura 8. Viscosidad de sacarosa
de las diferentes concentraciones de sacarosa-agua reportadas en la
bibliografía (Hunger, et. al.,
2003). Se pueden comparar las pendientes
y ordenadas al origen obtenidas respecto a las esperadas. Para el índice de refracción se tiene mteórico=0.0011
mexperimental=0.0011 (E=0%), bteórico=0.001, bexperimental=0.0009
(E=20%).
La figura 3 muestra
la tendencia de aumento inicial y disminución final de la viscosidad de la
disolución etanol-agua respecto a la concentración de etanol. En cambio, la
Figura 5 muestra un comportamiento lineal ascendente, la viscosidad aumenta al
aumentar la concentración de sacarosa. Esto último es perfectamente conocido en
la elaboración de jarabes, donde se hace una mezcla sacarosa-agua saturada,
cuya viscosidad es mucho mayor a la del agua pura, llegando a los 1,000,000 cP
(Aulton, 2004). Además el error en la medición de la viscosidad respecto a lo
reportado en la literatura es muy bajo (véase
Figura 8), manteniéndose la tendencia lineal ascendente esperada.
El caso del etanol
agua no muestra una tendencia constante en la variación de la viscosidad
respecto a la concentración, viscosidad etanol a 20ºC=1.20x10-2 P
(dina*s/cm3) = 1.20x10-3 kg/ms, viscosidad agua a 20ºC=
1.0x10-2 P (dina*s/cm3) = 1.0x10-3 kg/ms.
Ambas viscosidades son parecidas, pero al hacer la mezcla etanol-agua la
viscosidad aumenta, probablemente debido a que las interacciones puente de
hidrógeno etanol-agua pueden aumentar la fuerza de cizalla requerida para mover
las capas de la mezcla, tal como es definido viscosidad según la ley de Newton
de viscosidad, τ=𝜂*dv/dy
(Bird, 2006).
La tabla 6 muestra
los resultados de la medida de la viscosidad, los resultados obtenidos para
glicerina están cerca del valor esperado, 1.5 contra 2.081 kg/ms obtenido, una
variación de un 38%. En cambio, el propilenglicol muestra una variación mayor
del dato obtenido respecto al dato esperado de un 67%, dato esperado 0.0486
contra 0.151 kg/ms obtenido. Aquí es importante señalar dos aspectos a
considerar, 1) que el propilenglicol
no se comporta como un fluido newtoniano (Hunger, 2003), por lo que la densidad
obtenida debe ser llamada densidad aparente, y 2) que la velocidad medida es la velocidad media de caída y no la
velocidad terminal. Pérez, (et. al., 2010)
advierte que la medida de la velocidad media en lugar de la velocidad terminal
provoca grandes variaciones en los valores de viscosidad obtenidos respecto a
los esperados.
Las figuras 5 y 6
muestran una tendencia lineal del índice de refracción respecto a la
concentración de etanol y de sacarosa, ambos directamente proporcionales. Es de
esperar para el etanol esta tendencia pues el índice de refracción del etanol
es mayor que del agua pura, IR=1.333 del agua contra IR=1.3685 del etanol. Para
la sacarosa se observa la misma tendencia, pues el índice de refracción de
sacarosa (20ºC)=1.399 es mayor que del agua.
Nowokowska (1939),
reporta que la tendencia del índice de refracción respecto a la concentración
de etanol-agua tiene la misma tendencia que la viscosidad y debería tenerla.
Explica el efecto de la concentración sobre la viscosidad que cuando la capa de moléculas está sobre capas de moléculas vecinas, una
molécula doble, una de cada capa se forma instantáneamente y si hay suficiente
espacio disponible ésta doble molécula puede rotar y entonces disociarse, y
mediante éste proceso una capa de líquido puede fluir sobre la otra capa; sin
embargo, en una mezcla binaria tal como alcohol-agua las fuerzas que actúan
sobre éstos líquidos son más de repulsión que de atracción.
Nowokowska (1939)
también explica la tendencia no lineal en el índice de refracción. La
asociación molecular debida a fuerzas secundarias produce compuestos en los que
los electrones son compartidos y repelidos según Smith (1931) en la superficie
tal que el alcohol asociado debería ocasionar una disminución en el índice de
refracción.
Figura 9. Densidad relativa
reportada en la bibliografía (Nowakowska, et.
al., 1939) de las diferentes soluciones de etanol-agua. Se observa una
tendencia lineal igual a la obtenida experimentalmente. mteórico=-0.0021
mexperimental=0.0021 (E=0%), bteórico=1.0172, bexperimental=1.0153
(E=0.2%).
Figura 10. Viscosidad respecto a
la concentración de etanol-agua reportadas en la bibliografía (Nowakowska, et. al., 1939). Se observa que tanto
experimental como teóricamente se tiene la misma tendencia no lineal.
Figura 11. Índice de refracción
respecto a la concentración de etanol-agua (Nowakowska, et. al., 1939). Se observa una tendencia general no lineal. La
Figura 5 muestra la tendencia aparentemente lineal del índice de refracción
respecto a la concentración. Esto se debe a que medimos la mayor parte de los
datos de la parte lineal de la Figura 11, mientras que la parte no lineal solo
representa dos datos (70 y 90%).
Aplicaciones en la industria farmacéutica
-
En el departamento de control de
calidad de las empresas farmacéuticas se tiene que hacer pruebas de valoración
e identificación de sustancias, así que se determina la densidad y viscosidad
de materias primas.
-
A la hora de preparar emulsiones
y/o jarabes se necesita conocer la variación de la densidad de la solución de
acuerdo a la concentración de liposolubles o sacarosa, para emulsiones y
jarabes, respectivamente.
-
Para la granulación húmeda se
necesita conocer el valor de la viscosidad y de la densidad de las disoluciones
preparadas para que se adecuen al polvo, principio farmacéutico.
-
El índice de refracción se utiliza
en los estudios de preformulación de medicamentos así como un parámetro
indicado por la FEUM (Farmacopea de los Estados Unidos Mexicanos) para los
estudios de identidad del fármaco.
Conclusiones
·
Experimentalmente, la densidad
relativa, viscosidad e índice de refracción de las soluciones sacarosa-agua
tiene una tendencia lineal, tal como se esperaba por lo reportado en la
literatura.
·
Se determinó que la densidad
relativa de las soluciones etanol-agua tiene una tendencia lineal descendente
respecto a la concentración de etanol, tal como se esperaba.
·
Se determinó que no hay tendencia
lineal para la variación de las viscosidades de las diferentes soluciones
etanol-agua, tal como se esperaba por lo reportado en la bibliografía.
·
Se debe tener cuidado al
seleccionar el intervalo de concentraciones a medir, pues el índice de
refracción respecto a la concentración de etanol agua aparentemente tiene una
tendencia lineal, caso contrario a lo reportado en la literatura.
·
No variamos los factores que
modificaran la viscosidad, densidad e índice de refracción, principalmente la
temperatura, pero sí variamos la concentración de las muestras.
·
Medir la velocidad media en lugar
de la velocidad terminal no resultó conveniente para medir la viscosidad por el
método de la caída de la esfera para glicerol y propilenglicol.
Bibliografía
-Aulton, M.
(2004). Farmacia. Ciencia y diseño de
formas farmacéuticas (2ª ed.). España: Editorial Elsevier. Pp. 152-154, 284
ISBN: 8481747289
-Bird, R.,
Stewart, W. y Lightfoot (2006). Fenómenos
de transporte (1ª ed.). México, D. F.: Editorial Reverté
-Chang, R.
(2008). Fisicoquímica (3ª ed.). E. U. A.: McGraw-Hill. Pp. 272-275
-Connors, K.
(1980). Curso de análisis farmacéutico
(ensayo del medicamento) (1a ed.). España: Editorial Reverté. pp. 278-283
-Heidcamp,
W. (2010). Cell Biology Laboratory Manual.
Biology Department, Gustavus Adolphus College
-Hunger,
K. (2003). Industrial Dyes. Chemistry,
Properties, Applications (3ª ed.). Weinhem, Alemania: Wiley-VCH Verlad
GmbH. Pp. 12-15, 89, 192 ISBN: 3-527-30576-9
-Nowakowska, J. (1939). The refractive Indices of Ethyl Alcohol and Water Mixtures. Loyola University Chicago, Master’s Theses.
-Pérez, L.,
Méndez, A. y Ponce, M. (2010). Velocidad
terminal de una esfera descendente y la viscosidad de fluidos: diferencia entre
fluidos newtonianos y no newtonianos. J. Phys. Educ. Vol 4, No 2.
-Sun,
S. F. (2004). Physical Chemistry of
Macromolecules (2a ed.). pp. 983-985, 1016 Nueva York, E. U. A.: John Wiley
& Sons. ISBN: 0-471-28138-7
Anexos
Abreviaturas
mp= masa del picnómetro seco (g)
mps= masa del picnómetro con la solución (g)
ms=masa de la solución (g)
{ms=mps-ms}
tw= tiempo de flujo del agua en el método de
Ostwald (s)
t Et= tiempo de flujo de las soluciones de
etanol en el método de Ostwald (s)
𝜌e=densidad de la esfera (kg/m3)
𝜌f=densidad del fluido (kg/m3)
𝜌rel=densidad relativa (adimensional)
g=fuerza de gravedad (m/s2)
v=velocidad de la esfera (m/s)
𝜂=viscosidad (kg/ms)
𝜂1=viscosidad mezcla (kg/ms)
𝜂2=viscosidad agua pura 20ºC (kg/ms)
t1=tiempo de flujo de la mezcla (s)
t2=tiempo de flujo del agua pura
(s)
C=concentración solución etanol-agua (%)
Csac=concentración molar de la
solución sacarosa-agua (M)
Para el caso de la
solución 10% etanol-agua se tiene:
mpw=28.2919 g
mp=18.5565 g
mw=9.7354 g
mps10%=
28.155 g
mp10%=18.5794 g
ms10%=9.5756 g
Viscosidad
método de Ostwald
Para el caso de concentración 10% de etanol-agua
tenemos:
Viscosidad método
de la esfera caída
Para determinar la densidad de la esfera se
dividió el peso de ésta entre el volumen ocupado, dado por la fórmula
.
Por ejemplo, para la esfera 1:
Para el cálculo de la viscosidad usando la ley
de Stokes para una esfera ideal se tiene:
Para la glicerina se tienen los
siguientes datos:
g=9.8 m/s2
v=0.0039955 m/s
𝜌e=3.433
g/cm3=3,433 kg/m3 (promedio de las esferas 3 y 4)
𝜌f=1.261 g/cm3= 1,261 kg/m3
r=0.001325 m
La viscosidad reportada es de 1.5 N*s/m2=kg/ms
Para el propilenglicol:
g=9.8 m/s2
v=0.06033223 m/s
𝜌e=3,586
kg/m3
𝜌f=1,036
kg/m3 (promedio de las esferas 1 y 2)
r=0.00255 m
La viscosidad reportada a 25ºC es de 48.6
cP (mPa*s) = 0.0486 kg/ms





















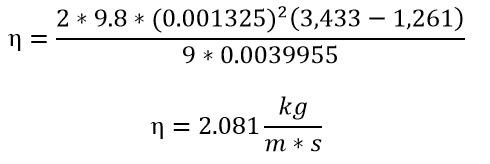


No hay comentarios:
Publicar un comentario
Deja tu comentario, puede ser anónimo. Todos son bienvenidos.