OBJETIVOS
OBJETIVO GENERAL
·
Determinar la
curva de disolución de un comprimido de ácido ascórbico.
OBJETIVOS ESPECÍFICOS
·
Determinar
el orden cinético de liberación de comprimidos de 500 mg de ácido ascórbico.
·
Calcular la
cantidad de ácido ascórbico presente en el fármaco.
·
Conocer el
tiempo que tarda en liberarse el fármaco de un comprimido a condiciones
fisiológicas.
INTRODUCCIÓN
Para que un fármaco pueda ser absorbido es necesario que se
encuentre en solución, por lo que la forma farmacéutica ejerce influencia en la
liberación del fármaco y por ende en los niveles plasmáticos obtenidos. La
disolución es el proceso por el cual una sustancia sólida entra al disolvente
para obtener una disolución. Noyes y Whitney, 1897, hicieron la primera
referencia sobre disolución en su artículo “The
rate of solution of solid substances in their own solution”.
La disolución de un sólido en un líquido puede ser explicada por
dos procesos consecutivos (Aulton):
Primero una reacción interfacial que resulta en la liberación de
las moléculas de soluto desde la fase sólida. Esto envuelve un cambio de fase,
entonces las moléculas del solido se convierten en moléculas de soluto dentro
del solvente. La solución el contacto con el sólido estará saturada.
Después de esto, las moléculas de soluto deberán migrar a través
de las capas límites que rodean al sólido. Éste paso envuelve el trasporte de
éstas moléculas lejos de la interfase sólido líquido hacia el seno de la fase
líquida bajo la influencia de la difusión o convección.
Entonces la concentración cambia en las capas límites de ser
saturada (Cs) en la superficie del sólido, a ser igual a la concentración del
seno de la solución (C).
Modelo de la raíz cuadrada: El efecto de la porosidad en la
liberación de fármacos a partir de una matriz insoluble se estudió por Higuchi
y expresó la ley de la raíz cuadrada: El espesor de la capa de difusión k es
proporcional a la raíz cuadrada del diámetro del volumen del medio de
disolución:
Modelo de los dos tercios: Higuchi y Hiestand desarrollaron las
expresiones para partículas esféricas donde la velocidad de difusión se
controla bajo la teoría de Nernst, considerando que la constante de
proporcionalidad era de 2:
Cinética de orden cero: Se puede observar en los casos donde se
disuelve una pequeña cantidad de producto sólido en un gran volumen de
disolvente, aquí la velocidad es constante con el tiempo e independiente de la
concentración de soluto:
Cinética de orden uno: A medida que el fármaco en estado sólido va
disminuyendo, la solución se va enriqueciendo con el soluto. Al ir aumentando
la concentración en la solución, la velocidad está en función de la
concentración de fármaco disuelto:
El ácido ascórbico es un cristal incoloro e inodoro, sólido
soluble en agua y con un sabor ácido. Es un ácido orgánico con propiedades
antioxidantes. En humanos el ácido ascórbico no puede ser sintetizado por lo
cual debe ingerirse a través de los alimentos. Esto se debe a la ausencia de la
enzima L-gulonolactona oxidasa que participa en la ruta del ácido úrico.
Figura 1. Molécula de ácido L-ascóbico y
tabletas de 500 mg.
DESARROLLO EXPERIMENTAL
RESULTADOS
Tabla 1. Resultados obtenidos de absorbancia muestras obtenidas del método de
disolución por canastillas a 37ºC, 120 rpm y una solución de HCl 0.1N
Tiempo
(min)
|
Vol.
Muestra (mL)
|
Vol
HCl 0.1 N (mL)*
|
Factor
de dilución
|
Absorbancia
|
1
|
1
|
9
|
10
|
0.20035
|
2
|
1
|
9
|
10
|
0.31982
|
3
|
1
|
9
|
10
|
0.56684
|
4
|
1
|
9
|
10
|
0.88101
|
5
|
1
|
9
|
10
|
1.15819
|
10
|
1
|
15
|
16
|
1.06191
|
15
|
1
|
15
|
16
|
1.29168
|
20
|
0.5
|
10
|
21
|
1.01989
|
25
|
0.5
|
15
|
31
|
0.29903
|
30
|
0.5
|
15
|
31
|
0.68475
|
35
|
0.5
|
50
|
101
|
0.36248
|
40
|
0.3
|
20
|
67.667
|
0.189
|
*Es el volumen de ácido clorhídrico que se adicionó a las mezclas
para hacer las diluciones. Se prefirió usar HCl 0.1 N en lugar de agua
destilada para no variar la solubilidad ni la disociación del ácido ascórbico.
Tabla 2. Datos para la curva tipo para ácido ascórbico a 242 nm proporcionados
por el manual de laboratorio de Diseño y Estabilidad de Medicamentos.
Conc (mg/mL)
|
Abs
|
2.00E-03
|
0.224
|
5.00E-03
|
0.4
|
7.50E-03
|
0.479
|
1.00E-02
|
0.581
|
1.20E-02
|
0.68
|
1.50E-02
|
0.836
|
2.00E-02
|
1.05
|
1.308
|
Figura 1. Curva tipo de ácido ascórbico en HCl 0.1 N a 242 nm.
Tabla 3. Concentraciones medidas de las muestras diluidas y concentración real
obtenida al multiplicar la concentración de las diluciones por su factor de
dilución según la tabla 1.
Tiempo
(min)
|
Concentración
muestra diluida (mg/mL)
|
Concentración
real
(mg/mL)
|
1
|
0.0012312
|
0.0123
|
2
|
0.00386961
|
0.0387
|
3
|
0.00932488
|
0.0932
|
4
|
0.01626311
|
0.1626
|
5
|
0.02238444
|
0.2238
|
10
|
0.02025817
|
0.3241
|
15
|
0.02533248
|
0.4053
|
20
|
0.01933018
|
0.4059
|
25*
|
0.00341048
|
0.1057
|
30
|
0.01192884
|
0.3698
|
35
|
0.00481173
|
0.486
|
40*
|
0.00098054
|
0.0664
|
*Datos
fuera del rango
Figura 2. Curva de disolución de un comprimido de 500 mg de ácido ascórbico. Se
muestra la concentración de ácido medida en la solución 0.1 N
Tabla 4. Cantidad de ácido ascórbico disuelto en el medio calculado
multiplicando la concentración de ácido ascórbico ya mostrada en la tabla 3 por
el volumen del solvente restante. Se fueron sacando 4 mL en cada determinación
para hacer la toma de muestra. Se midió el volumen final y se obtuvo un valor
de 955 mL.
Tiempo
(min)
|
Concentración
ácido ascórbico
(mg/mL)
|
Volumen
disolutor
(mL)
|
Cantidad
disuelta
(mg)
|
1
|
0.012312007
|
1000
|
12.3120072
|
2
|
0.038696142
|
996
|
38.5413573
|
3
|
0.093248824
|
992
|
92.5028334
|
4
|
0.162631126
|
988
|
160.679552
|
5
|
0.223844438
|
984
|
220.262927
|
10
|
0.324130651
|
980
|
317.648038
|
15
|
0.405319671
|
976
|
395.591998
|
20
|
0.405933835
|
972
|
394.567688
|
25*
|
0.105724918
|
968
|
102.34172
|
30
|
0.369794174
|
964
|
356.481584
|
35
|
0.48598485
|
960
|
466.545456
|
40*
|
0.066350125
|
956
|
63.4307193
|
*Datos fuera del rango
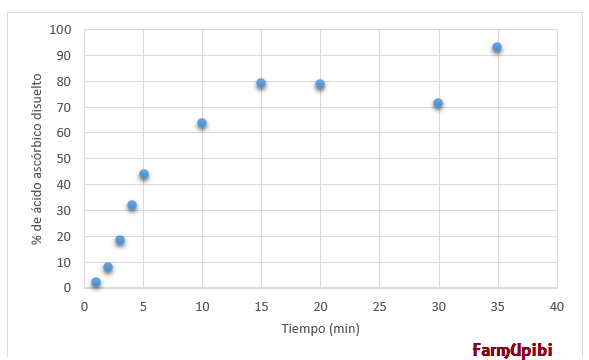
Figura 3. Cantidad porcentual de
fármaco liberado o disuelto en el medio de un comprimido de ácido ascórbido de
500 mg. El peso del comprimido fue de 1.1313 g. Se tomó como 100% los 500 mg de
ácido ascórbico contenidos en la tableta.
Figura 5. Regresiones lineales para
determinar si el perfil de disolución se adapta a alguno de éstos cuatro
órdenes. El más alto fue el orden dos con un r=0.9193
Figura 6. Ajuste para determinar si el perfil de disolución de los
comprimidos de ácido ascórbico se adapta a una cinética de primer orden.
DISCUSIÓN
La tabla 1 muestra las absorbancias leídas de las diluciones de
ácido ascórbico a 242 nm. Para preparar las disoluciones se usó HCl 0.1 N para
asegurarse que no hubiera cambios en la solubilidad que pudieran formar
precipitados, y porque tratándose de un ácido carboxílico polialcohol (Figura
1) se cambia su constante de disociación y podría dar lugar a variaciones en la
λmáx.
La Figura 1 muestra la curva tipo reportada por el manual de
laboratorio de Diseño y Estabilidad de Medicamentos. El coeficiente de
correlación es bastante bueno, de 0.9968. Sin embargo, no se reporta si fue
medido usando como disolvente HCl(ac) 0.1 N o agua destilada. Debe
tomarse esto en cuenta pues podría afectar tal y como se discutió
anteriormente.
La Figura 3 muestra la cantidad porcentual liberada de ácido
ascórbico. Se tomó en cuenta que la cantidad máxima liberada de ácido ascórbico
fue de 500 mg pues según se exige en la FEUM la cantidad no debería ser menor a
450 ni mayor a 550 mg. Entonces, se puede determinar que el tiempo que tarda el
medicamento en liberar el 50% de su principio activo es de 6 minutos, y el
tiempo que tarda en liberar el 90% de ácido ascórbico, ronda los 30 minutos.
La figura 5 muestra las curvas de correlación para los órdenes de
reacción cero, dos, ½ y 1/3. Se observa que ninguno de ellos tiene un
coeficiente de correlación mayor al de la cinética de orden uno. El orden cero
solo es para experimentos donde la cantidad de ácido ascórbico es muy pequeña o
la cantidad de solvente es máxima. No se ajusta al experimento. Sin embargo, el
orden cero se puede observar en los primeros 5 minutos según la Figura 2, pues
la cantidad liberada no interfiere con la cantidad que se va a disolver en la
capa límite, según lo expuesto en la introducción.
El orden dos tiene un buen coeficiente de correlación, de 0.9193.
Sin embargo se descarta por ser menor al de primer orden y porque el orden dos
no es común para perfiles de disolución, sólo en aquellos donde ocurre una
reacción de molecularidad dos o en que el fármaco interfiere al cuadrado de su
concentración.
El orden ½ y 2/3 propuestos por Higuchi y Higuchi-Hiestand,
respectivamente, no se ajustan a la cinética de disolución obtenida. El orden ½
es para esferas y la tableta usada no se ajusta a ese modelo (Figura 1). El
orden 2/3 es para aquellas que se ajustan al perfil de liberación de Nesnst
para soluciones iónicas. Dado el pH de 1.0 usado se considera que todo el ácido
acético y los alcoholes están en forma no ionizada por estar muy por debajo de su
pKa. Por tanto no se trata de soluciones iónicas.
La cinética de orden uno como se ve en la figura 6 se ajusta
bastante bien a los datos obtenidos, con valor de r=0.968. Según esto
k=pendiente, y la ecuación que describe el perfil de disolución debería quedar:
Donde t está dado en minutos y la cantidad de fármaco disuelto en
mg.
En la siguiente figura se muestra la cantidad de ácido ascórbico
liberado contra la cantidad de ácido ascórbico que debería liberarse usando una
cinética de primer orden. Se pude observar la proximidad de ambos valores. Según
esto la cantidad máxima de fármaco medida es de 477 mg, que está dentro del
límite establecido por la FEUM de ±10% para el contenido en peso de principio
activo de una forma farmacéutica sólida.
Figura
7. Se muestra la cantidad de fármaco liberado respecto al tiempo junto a la
cantidad calculada de fármaco usando una cinética de orden uno.
El disolutor usado fue el aparato mostrado en la portada. La
Figura 8 muestra la canastilla usada en la prueba. Debe estar hecha de acero
inoxidable que no permita la corrosión por la alta concentración de HCl que
hay. El nivel del líquido dentro del recipiente del solvente debe estar debajo
del nivel del líquido fuera que sirve para mantener el control térmico de éste.
Además el nivel de la canastilla debe estar debajo del nivel de ambos líquidos
para permitir la disolución del comprimido. La canastilla gira alrededor del
eje axial z.












No hay comentarios:
Publicar un comentario
Deja tu comentario, puede ser anónimo. Todos son bienvenidos.